
Bild: Björn Öberg
Nu kan vi styra över domedagsgenen
Vad sägs om att en gång för alla göra slut på malariamyggorna? Eller fästingarna? Med ny genteknik har det blivit möjligt att utrota i princip vilken sexuellt reproducerande art som helst. Nu vill forskare sätta gränser för människans nya makt över naturen.
Kinas diktator Mao Zedong hatade sparvar. År 1958 uppmanade han folket att utrota alla sparvar eftersom de stal spannmål från åkrarna.
Över hela landet förstördes bon. I skymningen gick folk ut i markerna för att hetsa sparvar med skramlande kastruller och långa vimplar. Kväll efter kväll föll utmattade fåglar till marken.
Mao krävde också att myggor, flugor och råttor skulle utrotas. Men det var mot sparvarna som kampanjen fick störst effekt – dock inte den avsedda. Med färre sparvar blev det fritt fram för svärmar av gräshoppor och andra insekter att kalasa på grödorna.
Året därpå bytte Mao ut sparvarna mot vägglöss på sin lista över dödsdömda arter, men skadan var redan skedd.
Kriget mot sparvarna ingick i Det stora språnget, ett misslyckat försök att modernisera Kina. En vanlig uppskattning är att uppåt 30 miljoner människor svalt ihjäl på några få år.
Samtidigt som den kommunistiska massmobiliseringen mot ”de fyra plågorna” rasade som värst i Kina, försökte forskare på andra håll i världen utveckla betydligt mer avancerade vapen mot icke-önskvärda arter.
Den unge entomologen George Craig vid University of Notre Dame i Indiana, USA, koncentrerade sig på myggan Aedes aegypti, som bland annat sprider gula febern och denguefeber. Han upptäckte en ärftlig faktor hos mygghannar som gör så att avkomman med stor sannolikhet också blir hannar. Det gav honom en idé: ”Kanske det går att hitta ett sätt att massuppföda mygghannar som ger upphov till hannar”, skrev han i Science i december 1960.
Om man med jämna mellanrum släpper ut sådana hannar borde det bli brist på honor, tänkte Craig. Och färre blodsugande honor borde betyda mindre smittspridning – och dessutom färre nya myggor i nästa generation.
George Craig lyckades aldrig visa att genetisk krigföring mot honor var en praktisk lösning på myggproblemet. När han presenterade sina rön betraktades flygbesprutning med DDT fortfarande som ett kostnadseffektivt och smart sätt att döda mygglarver. Men drömmen om att bekämpa skadliga organismer via deras gener levde vidare.
Ett viktigt steg togs i början av 00-talet. I lummiga Silwood park, en dryg timme väster om London, odlade evolutionsgenetikern Austin Burt bagerijäst i sitt laboratorium. Han använde jästcellerna för att studera ett slags extremt själviska gener.
Sexuell fortplantning innebär i vanliga fall att en viss gen har 50 procents chans att ta sig vidare till en individ i nästa generation. Den österrikiske munken Gregor Mendel beskrev sambandet redan för 150 år sedan, efter att ha odlat ärtor i trädgården utanför sitt kloster i nuvarande Brno, Tjeckien.
Men det finns gener som kräver mer än vad Mendels lagar medger. Austin Burts jästceller innehöll en gen som vid sexuell fortplantning i princip alltid förs vidare till nästa generation. Genen är ett slags framgångsrik parasit i arvsmassan.
Om parasiten finns i den ena av kromosomerna i ett kromosompar kan den lätt sprida sig vidare. Med hjälp av ett målsökande enzym fogar den in en kopia av sig själv på motsvarande plats även i den andra kromosomen. Efter en sexuell fortplantning finns parasiten i alla avkomlingar, och den sprider sig vidare på samma sätt i generation efter generation.
– Jag insåg att det kunde bli användbart mot myggor, och även mot andra arter, säger Austin Burt, numera professor i evolutionär genetik vid University College London.
Med traditionell genteknik är det lätt att framställa myggor som får färre eller svagare avkomlingar. Möjligen går det också att göra så att malariamyggor inte längre kan bära den farliga smittan.
Haken är att genförändrade myggor brukar ha svårt att klara sig i konkurrensen med vanliga myggor. De är helt enkelt sämre på att fortplanta sig.
Austin Burt presenterade en lösning på problemet redan år 2003. Den bygger på något han kallar gene drives, gendrivare: Foga samman ett valfritt arvsanlag med den genetiska parasiten. Med parasitens draghjälp kan anlaget sedan sprida sig i generation efter generation tills det finns hos alla individer. Den stora poängen är att tricket fungerar även om anlaget ger bäraren något sämre chanser att föröka sig.
Gendrivare kan användas på många sätt. Ett av Austin Burts förslag var att föra in en gen i myggor som ökar andelen hanlig avkomma. Enligt hans beräkningar skulle det efter ungefär tjugo generationer leda till att honorna tar slut och myggarten går under.
– För myggor i tropikerna handlar det om ungefär två år, säger Austin Burt.
På pappret var det en kraftfull idé. Men i verkligheten visade det sig att hans gendrivare är mycket svåra att konstruera. Så Austin Burts snillrika plan hamnade i byrålådan.
Men för knappt tre år sedan ändrades förutsättningarna. En ny metod som kallas crispr/Cas9 revolutionerade gentekniken. En av pionjärerna var Emmanuelle Charpentier, som då arbetade vid Umeå universitet. Det mödosamma arbetet med att redigera arvsmassan hos levande organismer blev plötsligt enkelt och billigt.
Sedan dess har tusentals laboratorier runt om i världen börjat använda tekniken. Och biologer har upptäckt att crispr-tekniken är som klippt och skuren för att fungera som gendrivare. Därmed uppstår nya möjligheter att genförändra olika arter i naturen – eller utplåna dem helt från jordens yta.
– Det här ger oss en makt över naturen som vi tidigare aldrig har haft, säger Magnus Lundgren, crispr-forskare och mikrobiolog på Institutionen för cell- och molekylärbiologi vid Uppsala universitet.
Han känner inte till några svenska experiment med gendrivare, men är väl insatt i ämnet. Forskningsfältet är nytt. Gentekniknämnden – som ger råd om genteknik till regeringen och myndigheter – har precis börjat diskutera frågan.
Hittills har forskningen om crispr-baserade gendrivare till stor del handlat om teoretiska resonemang. Kevin Esvelt, som är evolutionsbiolog vid Harvard university i USA, hör till dem som först insåg vad tekniken skulle kunna åstadkomma.
– De potentiella fördelarna är svindlande. Det är mycket troligt att vi kan använda gendrivare för att utplåna malaria, denguefeber, borrelia och många andra sjukdomar, säger han.
Förutom att bekämpa smittspridare vill han utveckla gendrivare mot djur och växter som hamnar i en ny världsdel och rubbar den ekologiska balansen. En sådan invasiv art är agapaddan i Australien.
Sockerrörsodlare i nordöstra Australien importerade år 1935 ett hundratal paddor och släppte ut dem på sina fält i hopp om att de skulle äta upp skadeinsekter. Agapaddorna hade dock ingen långsiktig effekt på insekterna. Däremot står det klart att paddorna spritt sig och ökat i antal till uppskattningsvis 200 miljoner – trots mängder av försök att hejda dem med fällor, stängsel, kemikalier och golfklubbor.
Bland de främmande arterna i Sverige finns mördarsniglar, signalkräftor och fisken svartmunnad smörbult. Den sammanlagda kostnaden för skador orsakade av invasiva arter i Europa motsvarar över 100 miljarder kronor per år, enligt EU-kommissionens uppskattning.
Gendrivare skulle också kunna göra nytta inom jordbruket, enligt Kevin Esvelt.
– Vi kommer att revolutionera jordbruket genom att genförändra skadedjur så att de inte längre tycker om smaken av grödorna, eller så att de dör när vi sprejar dem med ämnen som är totalt harmlösa för andra organismer, säger han.
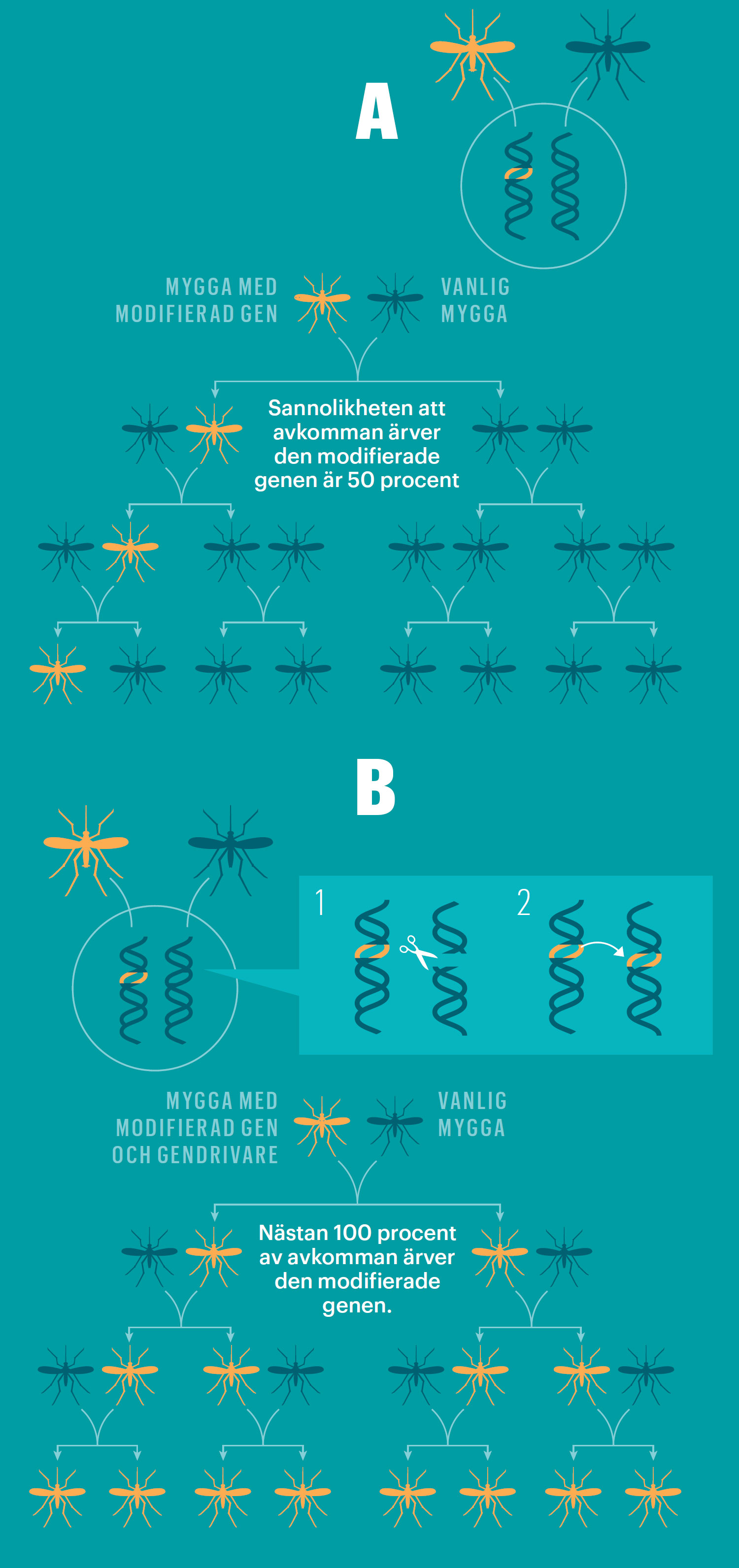
Kedjereaktion sprider gener
Med draghjälp från en gendrivare kan förändrade arvsanlag sprida sig snabbare än vad den vanliga ärftligheten medger.
Bild: Johan Jarnestad
En annan möjlighet är att stänga av gener som gjort ogräs och skadedjur resistenta mot relativt miljövänliga bekämpningsmedel. Därmed skulle det bli onödigt för bönder att ständigt ta till nya och kanske farligare kemikalier för att skydda sina grödor.
Kevin Esvelt har storslagna visioner, men han inser att både forskare och samhället i övrigt måste få en chans att diskutera den nya tekniken. Det var ett av skälen till att han förra sommaren publicerade en detaljerad rapport om gendrivarnas möjligheter och risker. Bland medförfattarna finns den amerikanske genetikern George Church, känd för banbrytande insatser i arbetet med att avläsa människans hela arvsmassa.
En uppenbar risk är att en gendrivare konstruerad för att till exempel utrota Australiens agapaddor hamnar på avvägar. Om en padda som bär på en sådan gendrivare tar sig till Amerika kan arten försvinna även från sina ursprungliga hemtrakter.
Det är också tänkbart att en insekt eller annan organism med en konstgjord gendrivare lyckas para sig med en individ från en närbesläktad art. I så fall får gendrivaren möjlighet att sprida sig inom den nya arten, och sedan kanske till ytterligare arter.
Vid sidan om risker som redan nu går att föreställa sig, kan något helt oväntat inträffa, antingen kortsiktigt eller till följd av evolutionära processer. Biologi är ett snårigt ämne, och den ekologiska ingenjörskonstens historia är full av bakslag. Olyckor kan inträffa redan i laboratorieförsök.
– Risken finns att någon forskare i ett tidigt skede klantar sig och oavsiktligt ändrar en art i naturen. Det skulle allvarligt rubba förtroendet för forskare som utvecklar den här tekniken, säger Kevin Esvelt.
En enkel åtgärd är att utföra alla experiment med tropiska myggor som innehåller en gendrivare i laboratorier utanför myggartens utbredningsområden. Det är förstås ingen idiotsäker strategi. En mygga kan färdas långt om den hamnar i ett flygplan, en buss eller en båt.
Därför rekommenderar Kevin Esvelt och hans medarbetare att gendrivare konstrueras så att de blir beroende av någon ovanlig kemikalie som bara finns i laboratoriet. Dessutom tycker de att forskare som arbetar med en konstgjord gendrivare för säkerhets skull också ska konstruera ett slags återställare, en andra gendrivare att släppa ut för att så långt som möjligt ändra tillbaka en oavsiktlig genförändring i naturen.
De goda råden fick dåligt gensvar. I våras hörde Kevin Esvelt rykten om ett första försök att genförändra insekter med en crispr-baserad gendrivare. Ett par utvecklingsbiologer vid University of California hade stängt av en gen hos bananflugor så att de blev gula i stället för brunsvarta.
Tekniken fungerade utmärkt. Gendrivaren överförde mutationen till 97 procent av flugorna i varje ny generation. Men forskarna hade inte brytt sig om några andra försiktighetsåtgärder än att försöka hålla flugorna instängda.
Kevin Esvelt blev bestört. Han ringde upp flugforskarna tre dagar innan deras resultat skulle publiceras i Science, och övertalade dem att lägga till ett resonemang om risker i sin artikel.
– Redaktörerna på Science borde ha vetat bättre än att sprida resultaten utan en diskussion om säkerhetsåtgärder, säger Kevin Esvelt.
En genförändring som i värsta fall färgar världens bananflugor gula kanske inte skulle vara någon katastrof. Men det första publicerade experimentet med insekter blev en väckarklocka. Insikten spred sig om att vissa laboratorieförsök skulle kunna utlösa en kedjereaktion av mutationer hos vilda arter.
I somras samlade den amerikanska vetenskapsakademin NAS experter till ett möte om gendrivare. Enligt planerna ska deras säkerhetsföreskrifter vara klara i slutet av 2016.
Ett liknande möte hölls för fyrtio år sedan i den kaliforniska badorten Asilomar. Då var syftet att reglera nya metoder för att flytta bitar av arvsmassa mellan olika arter. Det fanns en oro för att laboratorier skulle släppa ut farliga bakterier eller virus. Med tiden visade det sig att den oron var överdriven. Men gendrivare har betydligt större potential att faktiskt påverka organismer i naturen.
– Vi måste vara försiktiga. Men att säga nej är också ett val. Man ska komma ihåg att över tusen barn dör av malaria varje dag. Jag tror att gendrivare är vår bästa chans att lösa det problemet inom rimlig tid, säger Kevin Esvelt.
Man hoppas att det blir möjligt att genförändra malariamyggor så att de blir fria från malariaparasiter. Om inte det fungerar anser han att man bör använda gendrivare för att utrota myggorna.
Magnus Lundgren hör också till dem som bedömer att gendrivare någon gång i framtiden kan bli ett vapen mot insekter som sprider sjukdomar. Men vem ska bestämma över hur tekniken används?
– Om det gäller myggor så bör i princip alla länder som har arten få vara med om beslutet, säger han.
Saken blir ännu mer komplicerad av att det är så enkelt att arbeta med crispr/cas9. Tekniken används redan vid laborationer i skolor, liksom av entusiastiska biohackare. Medan myndigheter och lärda sällskap utreder frågan om gendrivare någonsin ska få släppas ut, är det fullt tänkbart att någon genteknisk frifräsare går från ord till handling.
I våras publicerade biologer och etiker från Europa och USA ett öppet brev som tog avstånd från alla försök att använda crispr-tekniken till att genförändra människor. En månad senare rapporterade forskare i Guangzhou, Kina, att de ändrat en gen i mänskliga embryon. Syftet var inte att skapa genförändrade barn; de gjorde sina försök på embryon med en kromosomavvikelse som hindrar en normal fosterutveckling. Trots det blev experimentet mycket omstritt.
– Jag skulle inte bli förvånad om kinesiska forskare blir först även med att testa gendrivare, säger Magnus Lundgren.
Därmed inte sagt att misstagen från Det stora språngets tid kommer att upprepas.
– I dag skulle man lätt kunna göra mycket bättre ekologiska analyser än vad Mao och hans hantlangare gjorde. Vad de höll på med var väldigt ogenomtänkt. Men historien om sparvarna visar hur otroligt stora skadorna kan bli om man inte förstår hur ett ekosystem fungerar, säger Magnus Lundgren.
Klipptekniken utvecklades i Umeå

Många bakterier har ett slags immunförsvar som känner igen och klipper sönder arvsmassan hos invaderande virus. Emmanuelle Charpentier vid Umeå universitet och hennes medarbetare har visat att detta system (crispr/Cas9) kan användas som en målsökande dna-sax. En gendrivare innehåller dna som kodar för en sådan sax. När cellen lagar avklippt dna kan en ny kopia av gendrivaren fogas in i snittet.
Läs mer i Genteknikens andra revolution (F&F 7/2014).
Lagarna ligger efter
Forskare som vill göra laboratorieexperiment med gendrivare måste söka tillstånd hos Jordbruksverket. Men myndigheten har inga besked om vilka säkerhetsåtgärder som krävs.
– Det här är så nytt att vi inte kan säga att vi har någon större beredskap. Den dagen vi får in en ansökan så får vi ta ställning till den, säger Heléne Ström, handläggare på Jordbruksverket.
Försök med gentekniskt ändrade organismer ute i naturen måste uppfylla kraven i ett EU-direktiv från 2001. Utvecklingen av den så kallade crispr-tekniken och andra metoder har gjort direktivet föråldrat. I flera år har EU-kommissionen utlovat en uppdatering – hittills utan resultat.









































