Bild: Johan Marklund
De odlar hud i kamp mot svåra infektioner
Svåra, akuta vävnadsinfektioner kan på bara några dagar leda till amputation eller i värsta fall död. Nu vill forskare på Karolinska institutet ta hjälp av konstgjord hud för att snabbt ge rätt behandling till rätt patient.
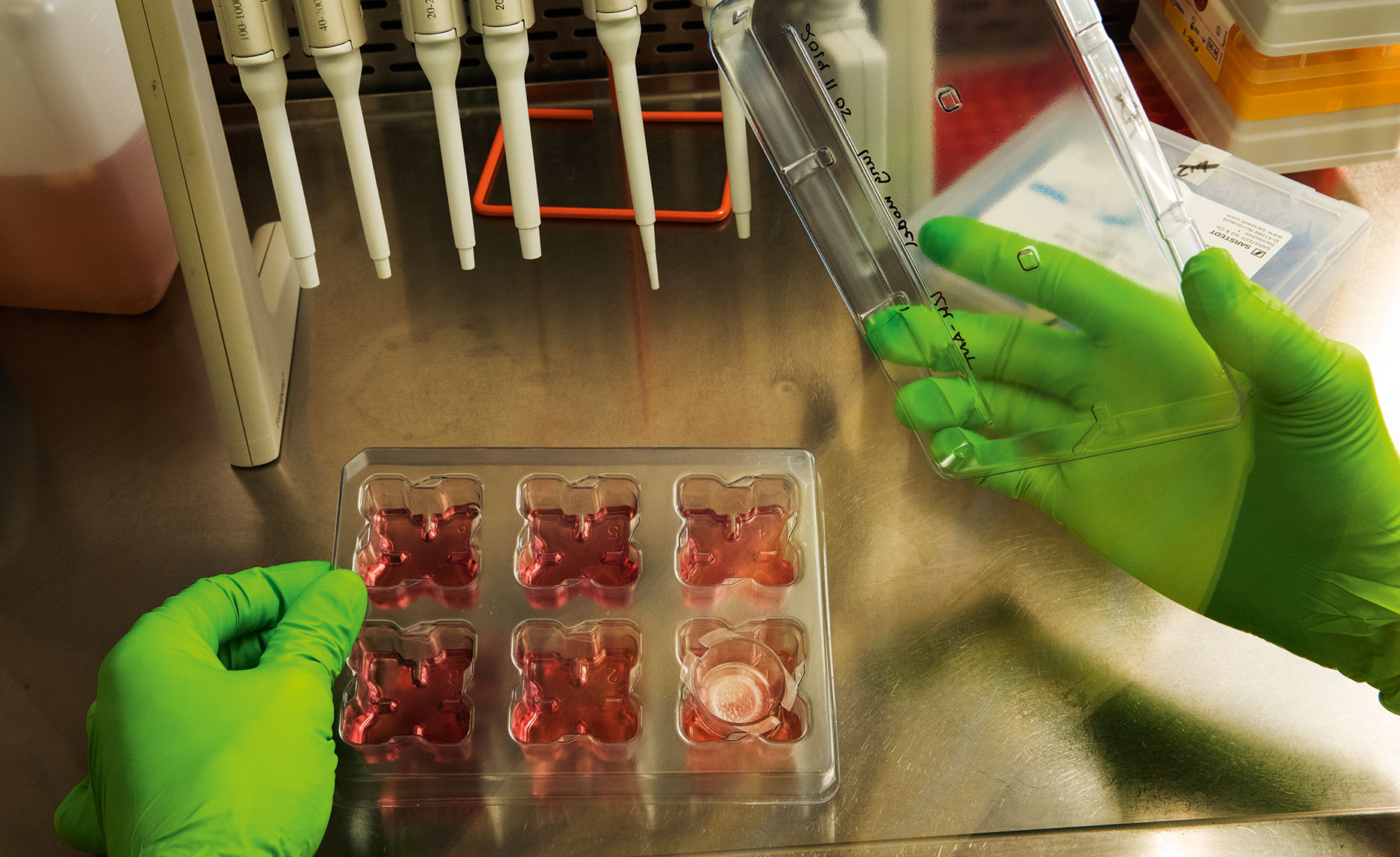
På ett laboratorium intill Karolinska sjukhuset i Huddinge växer konstgjord hud. Tunna lager hudceller odlas på många ställen i världen, men det som är speciellt i det här labbet är att huden är så lik den vi människor har. Tittar man närmare märker man att den är tredimensionell. Den är komplex. Den innehåller mycket av den variation av celltyper som finns i våra egna kroppar.
En hel del saknas visserligen, som hårfolliklar, svettkörtlar, muskelceller och blodkärl, men mycket annat viktigt lever och växer i hudmodellen. Här finns exempelvis keratinocyter som bildar det yttre skyddande hudlagret. Under det finns fibroblaster, som spelar en central roll när skadad hud ska repareras. I olika lager finns också makrofager, mycket viktiga immunceller som tar död på invaderande mikroorganismer. Forskarna har också haft viss framgång med att etablera fettceller i hudmodellen, celler som tycks vara betydelsefulla vid just inflammationer.
– Även om den är artificiell, och inte lika komplex som en normal hud, kan vi ändå efterlikna de inflammatoriska svar som sker i normal hud. Så det är ett värdefullt verktyg, säger Mattias Svensson, som är docent i immunologi och som leder den grupp som tagit fram den konstgjorda vävnaden.
Köttätande bakterier
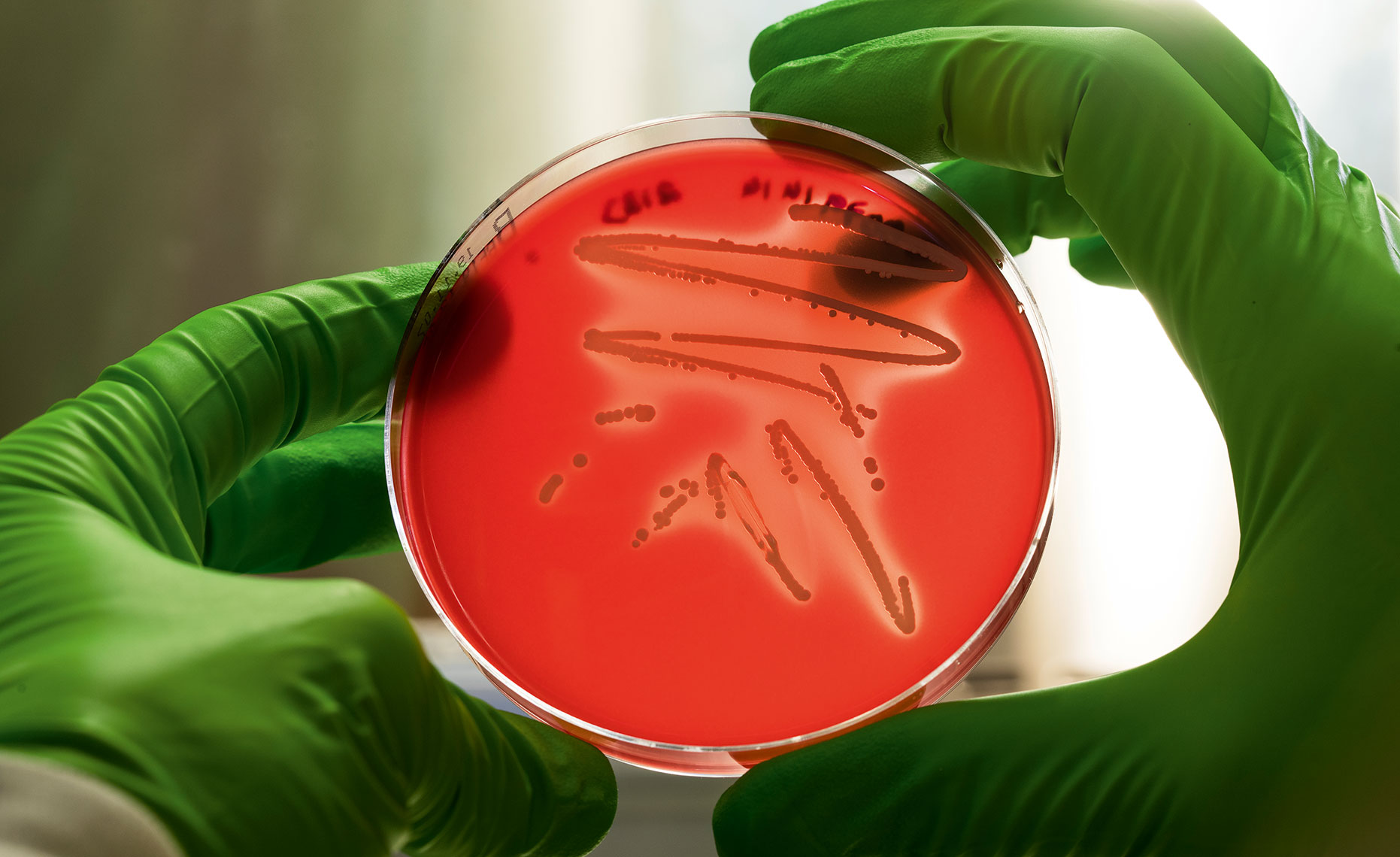
Den konstgjorda huden, och även konstgjord lungvävnad som gruppen arbetar med, är viktiga delar av ett större forskningsprojekt. Under fem år har forskarna arbetat inom det EU-finansierade projektet Infect, som nyligen avslutades. Det syftade till att bättre förstå nekrotiska djupvävnadsinfektioner, det som ibland med stora rubriker beskrivs som ”köttätande bakterier”. Det finns nämligen bakterier – vanliga bakterier som många av oss bär på och som för det mesta är ofarliga – som under vissa omständigheter kan bli katastrofala. Ett sådant exempel är grupp A-streptokocker.
– Sådana bakterier kan ge upphov till halsfluss. Det farliga är om de kommer ut i blodet eller vävnaden, säger Anna Norrby-Teglund, professor i medicinsk mikrobiell patogenes vid Karolinska institutet, och den som lett Infect-projektet.
Om oturen är framme, om speciellt aggressiva stammar av sådana här bakterier infekterar och får fäste i vävnad, då kan förloppet vara väldigt snabbt, på bara några dagar. Hud och annan mjuk vävnad dör, det sker nekros. Amputation kan vara nödvändigt för att hejda förloppet, men ibland räcker det inte för att rädda patientens liv.
Det här är tack och lov ovanligt, men just för att det är så ovanligt och förloppet går så snabbt är det också svårt att upptäcka i tid och svårt att studera. Det här ville forskarna i Infect-projektet ändra på.
– Det finns olika bakterier som kan ge upphov till infektionerna. Patienterna kan också skilja sig åt – de kan ha olika känslighet och olika underliggande faktorer. Det är det som gör det så komplicerat att känna igen patienterna på kliniken.
Infekterade den konstgjorda huden
Forskarna bestämde sig för att samla in data. Mycket data. Tillsammans med kliniker främst i Sverige, Norge och Danmark lyckades man identifiera 409 patienter med akuta djupvävnadsinfektioner. Man tog vävnad, blodprov, isolerade bakteriestammar och samlade in information om cirka 2000 kliniska variabler per patient, allt från ålder och kön till medicinska data om patientstatus och behandlingsförlopp.
– Så det är ett väldigt, väldigt fint material. Helt unikt. Det är världens största patientkohort (grupp individer) när det gäller kliniska data, säger Anna Norrby-Teglund.
Bakterier från patienterna kunde man sedan använda för att infektera den konstgjorda huden, och i detalj studera sjukdomsmekanismer. Redan nu har forskarna fått nya viktiga insikter, som att de bakterier som ger upphov till akuta infektioner kan bilda biofilm, ett slags tät och skyddande gel, djupt inne i vävnaden. Det här såg man i minst en tredjedel av fallen. Bakterierna blir då mindre känsliga för antibiotikabehandling, och kan även ligga gömda under lång tid för att sedan blossa upp på nytt.
Rätt behandling till rätt patient vid rätt tillfälle
Ett mål med forskarnas arbete är att få fram förutsättningar för en mer individanpassad behandling. Rätt behandling till rätt patient och vid rätt tidpunkt. Det här är fokus för de två multinationella projekt som nu tar över efter Infect. Peraid och Permit kallas de nya projekten som ska löpa under fyra år. Genom ett utökat samarbete mellan laboratoriet i Huddinge och läkare ute på kliniker hoppas man kunna ta fram och testa hur behandlingar riktade till specifika patientgrupper skulle kunna se ut. Tanken är att de mest lovande idéerna sedan ska kunna prövas i större kliniska studier och förändra hur akuta djupvävnadsinfektioner behandlas i framtiden.
Forskarna vill även undersöka om deras upptäckter kan förbättra behandlingen av andra typer av infektioner med liknande förlopp, exempelvis sepsis, blodförgiftning.
– Vi vill också utveckla verktyg som man kan använda ute på kliniken vid sängen för att automatiskt räkna ut vad för slags infektion en patient kan ha.
Sådana verktyg baseras på två olika strategier. Dels letar forskarna efter specifika biomarkörer, ämnen hos patienten som kan avslöja vilken typ av infektion som rasar i kroppen. Dels finns ju alla de där patientdata som Infect-projektet samlade in med 2 000 olika variabler plus blod- och vävnadsprover. Allt det här kan analyseras med hjälp av AI, maskininlärning. På så sätt skulle en läkare snabbt kunna få fram en profil av sin nyinsjuknade patient och lättare välja rätt behandling.
Testa behandlingar på konstgjord hud
Mattias Svensson arbetar vidare med sin konstgjorda hud. Han vill inte bara studera infektionsförlopp, utan även använda huden för att pröva olika behandlingar vid olika typer av infektioner, ett arbete som forskarna redan påbörjat. Tanken är också att göra huden ännu mer lik riktig mänsklig vävnad. För att det ska lyckas krävs fler celltyper. Blodkärl och lymfkärl står högt upp på önskelistan, men de är svåra att odla i laboratoriet. Det är svårt att isolera de nödvändiga celltyperna från annan vävnad och svårt att få dem att överleva. Sedan måste man på något sätt få dessa celler att bygga tunna små rör med samma typ av funktion som riktiga kärl, en gåta som forskarna ännu inte löst.
– Det skulle kräva ett ganska stort utvecklingsprojekt, men det skulle vara fantastiskt, därför att då skulle vi vid en viss tidpunkt kunna tillföra någonting till den odlade huden.
Exempelvis skulle man kunna tillföra läkemedel och följa hur det påverkar sjukdomsförloppet, eller föra in immunceller i den takt som de normalt når infektionen. Man skulle också med hjälp av ett lymfsystem kunna samla upp det som kommer ut från den infekterade vävnaden.
– Det är lite visionärt, säger Mattias Svensson, men jag tror att det är möjligt.