
Var går gränsen? Modern genteknik gör det möjligt att ändra arvsmassan hos mänskliga embryon. Försök pågår redan i dag – men hittills har de avbrutits på ett tidigt cellstadium.
Bild: Anders Kjellberg / Dogday design, iStock
Farlig forskning: Oroade experter drar i bromsen
Tiden är ännu inte mogen för GMO-människor. Det anser initiativtagarna till ett globalt toppmöte om att redigera människans arvsmassa. Men det blir allt svårare att stoppa omstridd forskning.
Han ser påfallande alldaglig ut, en liten gubbe med grått skägg, kostym och randig slips. Hans tal är desto mer ödesmättat:
– Vi tar på oss ett tungt ansvar för vårt samhälle, för vi förstår att vi kan befinna oss på randen till en ny era i människans historia.
Nobelpristagaren David Baltimore, 77, inledningstalar vid ett globalt toppmöte om möjligheten att genförändra människor. Det är fullsatt i den stora föreläsningssalen på National academy of sciences i Washington D.C., USA. Bland medarrangörerna finns även brittiska Royal society och Kinas vetenskapsakademi.
I flera miljarder år har evolutionen format livet på jorden. Är tiden nu mogen för människan att bli den första art som börjar redigera sitt biologiska arv efter eget huvud? Den frågan ska biologer, etiker, jurister och en intresserad allmänhet diskutera under tre dagar.
David Baltimore nämner framtidsromanen Du sköna nya värld från år 1932. Författaren Aldous Huxley beskriver hur människor tillverkas industriellt i syfte att uppfylla givna funktioner i samhället.
– Varningen i hans bok bör vi ta till oss, nu när vi står inför en nytt och kraftfullt sätt att forma mänskligheten, säger David Baltimore.
Han talar om en metod med det otympliga namnet Crispr/Cas9 som gör det enkelt och billigt att redigera arvsmassa. En av pionjärerna, mikrobiologen Emmanuelle Charpentier, arbetade vid Umeå universitet när hon presenterade sina mest banbrytande resultat för drygt tre år sedan. Även hon deltar i mötet i Washington.
– Som ni nog kan föreställa er så känner jag mig mycket berörd av hur den här teknologin kommer att användas i framtiden, säger hon.
Konsten att klippa och klistra i arvsmassa började utvecklas i början av 1970-talet. Gentekniken väckte hopp om nya läkemedel – men också oro för vad som skulle kunna hända om människan började manipulera det biologiska arvet.
I februari 1975 enades genforskare vid ett berömt möte i den kaliforniska badorten Asilomar om ett moratorium. De skulle avstå från vissa experiment i väntan på bättre kunskap om eventuella risker. Inledningstalaren då – liksom i dag – var David Baltimore.
Under det senaste året har han dragit paralleller mellan Crispr/Cas9 och diskussionerna vid det historiska mötet i Asilomar för fyrtio år sedan. Då som nu var frågorna många: Vem ska fatta besluten? Kan experimenten utlösa en katastrof? Vilken kunskap saknas?
Även inom andra forskningsfält är Asilomar en utgångspunkt för etiska diskussioner. Det gäller bland annat nanoteknik, artificiell intelligens, självstyrande krigsrobotar och så kallad geoengineering, som går ut på att förändra klimatsystemet för att motverka den globala uppvärmningen. Geoingenjörerna valde till och med att hålla ett toppmöte i Asilomar.
För några år sedan blev virologer osams om försök att genförändra influensavirus så att det blir mer smittsamt. Förespråkarna menade att experimenten behövs för att utveckla vacciner och behandlingar. Motståndarna krävde ett moratorium – dock utan framgång – med hänvisning till Asilomar.
Den amerikanske bioetikern Jonathan Moreno menar att det har blivit en reflex att använda Asilomar som förebild för etiska diskussioner, att Asilomar genom åren blivit nästan lika mytomspunnet inom forskningsetiken som Woodstock är inom populärkulturen. Han tror att folk har glömt hur geggig tillställningen i själva verket var.
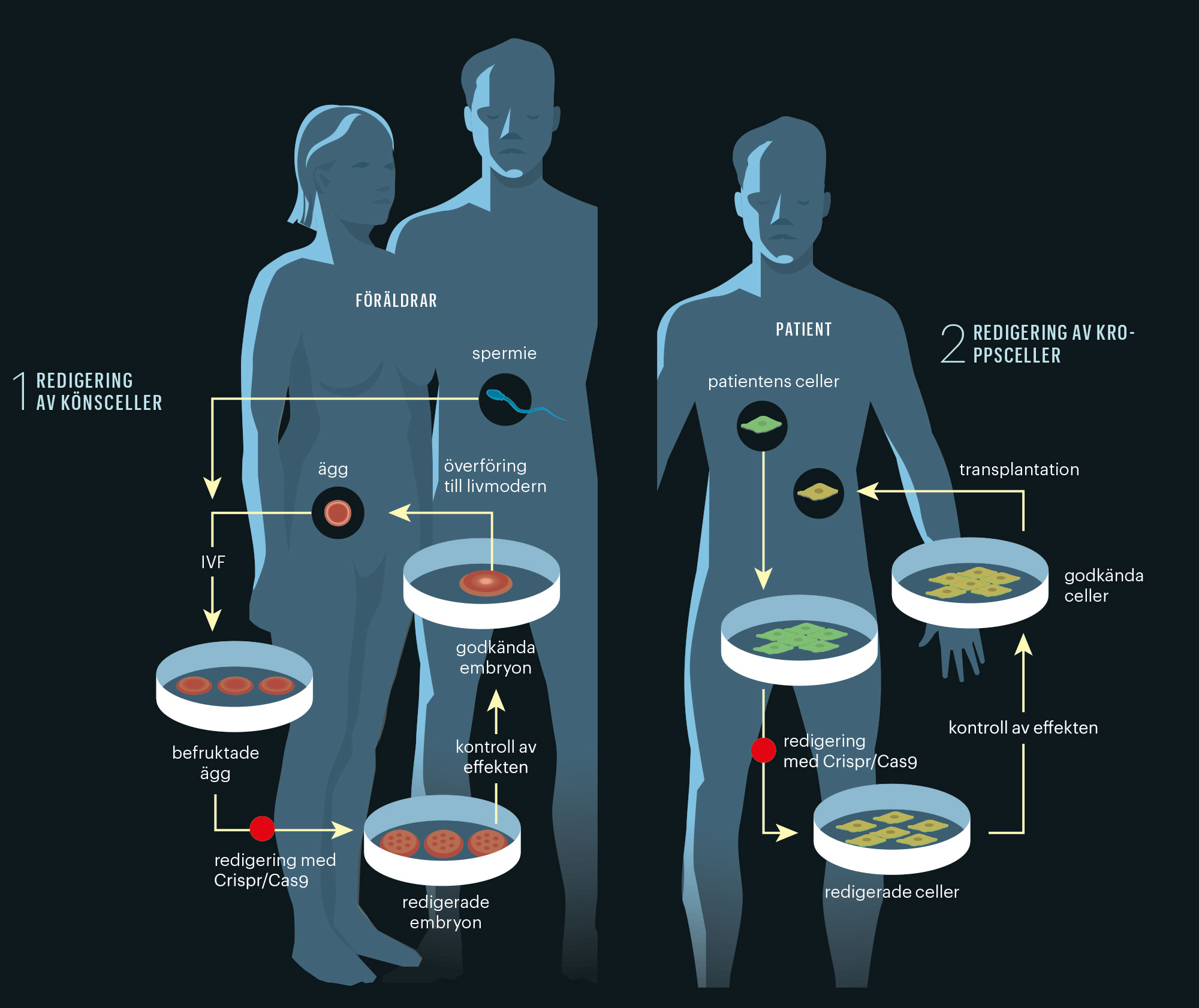
Två slags redigering
Så kallad genterapi leder till förändringar av arvsmassan som inte påverkar kommande generationer. Det gör däremot redigering av könsceller.
Bild: Johan Jarnestad
Mötet i Asilomar var en direkt följd av genteknikens födelse. Våren 1974 rapporterade forskare i USA att de hade lyckats stoppa in en bit dna från en groda i arvsmassa från en tarmbakterie. För första gången hade biologer alltså fogat samman dna från två vitt skilda arter. I en artikel om genombrottet i Forskning & Framsteg skrev molekylärbiologen Lennart Philipson att den så kallade hybrid-dna-tekniken bland annat skulle kunna leda till bakterier som tillverkar mänskligt insulin.
Samtidigt väckte tekniken oro. En grupp amerikanska molekylärbiologer – inklusive David Baltimore – bad i ett öppet brev sina kolleger i hela världen att frivilligt avstå från vissa experiment. De varnade för att genmanipulerade bakterier eller virus i värsta fall skulle kunna smitta människor med cancer. Andra farhågor var att bakterier skulle börja tillverka nya gifter, eller bli resistenta mot antibiotika. Brevskrivarna föreslog att genforskare skulle träffas för att diskutera riskerna.
Mötet började måndagen den 27 februari 1975. På kursgården Asilomar längst ut på Monterey-halvön i Kalifornien samlades 150 inbjudna biologer, några jurister samt dryga dussinet journalister (som tvingats gå med på att inte rapportera om mötet förrän det var slut). Arrangörerna fick omedelbart kritik för att ha stängt allmänheten ute.
Efter flera dagar av mestadels tekniska diskussioner påpekade en av juristerna att laboratorier kan bli stämda om någon anställd kommer till skada, och att statliga myndigheter har ett ansvar för att reglera arbete med hybrid-dna-tekniken.
Hotet om att myndigheter kanske skulle lägga sig i verksamheten bidrog till att mötesdeltagarna den sista dagen bestämde sig för att själva ta initiativet. Forskarna kom överens om att sätta gränser för sitt eget arbete. Experiment som ansågs ofarliga skulle få fortsätta. För andra experiment skulle ett moratorium gälla tills de tänkbara riskerna var utredda.
Trots budskapet från forskarna om att de hade läget under kontroll fylldes tidningarna av larm om den nya tekniken, även i Sverige. Debattören Nordal Åkerman krävde stopp för planerna på att bygga ett ”högrisklaboratorium” för experiment med hybrid-dna i Uppsala – och förfasades över en idé om att genförändra bakterier så att de kan bryta ner oljespill till havs. ”Vad händer om bakterien som äter olja tar sig in i ett passagerarplan och får effekt först när detta befinner sig över Atlanten?” frågade han sig i Dagens Nyheter.
I efterhand har farhågorna från Asilomar visat sig vara överdrivna. Inga katastrofer har inträffat. I stället har gentekniken levererat insulin och mängder av andra läkemedel. Den har också lett till genförändrade grödor och grundläggande insikter om hur arvsmassan fungerar.
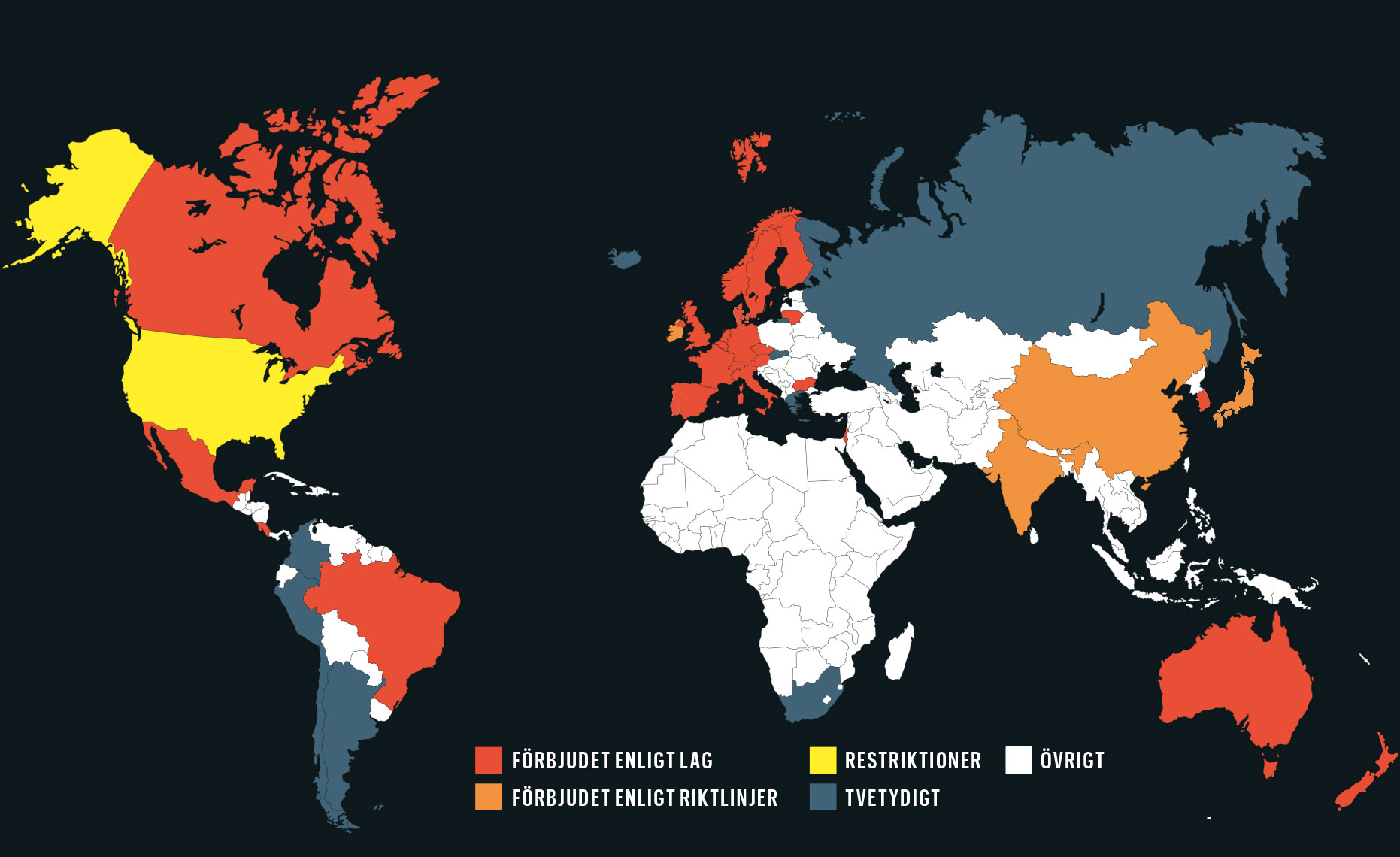
Vad säger lagen om att genändra mänskliga könsceller?
Källa: Trends in Molecular Medicine August 2015, Vol. 21, No. 8 och Bioteknologirådet
Bild: Johan Jarnestad
Frågan om att ändra människans biologiska arv fanns också med i de mediala svallvågorna efter Asilomar. Men i genteknikens barndom var det i praktiken omöjligt. Molekylärbiologernas verktyg var alltför trubbiga.
Crispr/Cas9 har ändrat på det. Det har blivit enkelt att ta bort, förändra eller föra in gener på valfri plats i arvsmassan hos i princip vilken organism som helst. Metoden har spritt sig till tusentals laboratorier runt om i världen. Redan för två år sedan lyckades kinesiska forskare använda den till att genförändra apor. Förmodligen skulle det gå att göra samma sak med människor.
– Det otänkbara har blivit tänkbart, säger David Baltimore.
I våras började rykten cirkulera om att flera forskargrupper var i färd med att ändra arvsmassan hos mänskliga embryon. David Baltimore bestämde sig för att försöka stämma i bäcken. I mars publicerade han och andra tongivande forskare ett öppet brev i tidskriften Science. De uppmanade sina kolleger i hela världen att avhålla sig från att genmanipulera människor – även i länder utan förbud – medan politiker och experter resonerar om följderna.
Mindre än två veckor senare rapporterade forskare vid Sun Yat-sen university i Guangzhou, Kina, att de hade genmanipulerat mänskliga embryon med Crispr-tekniken. Nyheten väckte starka reaktioner.
Forskarna hade ändrat en gen som kan orsaka blodsjukdomen talassemi. De utgick från embryon med en kromosomavvikelse som hindrar en normal fosterutveckling. Syftet var aldrig att skapa ett genmanipulerat barn, bara att testa tekniken.
I Kina är det lagligt att genförändra mänskliga embryon, men inte att överföra ett sådant embryo till en kvinna. Samma sak gäller i Sverige. Men en forskare som vill upprepa det kinesiska försöket kan bli stoppad av en etikprövningsnämnd.
Forskarna i Guangzhou har fått kritik för slarv som gör resultaten svårtolkade. Deras försök ledde till att arvsmassan förändrades på fler ställen än som var meningen. Med bättre varianter av Crispr-tekniken minskar risken för sådana bomskott. Den riktigt svåra avvägningen handlar om hur liten risk som är acceptabel.
Experimentet understryker behovet av en bred diskussion om att genförändra människor, enligt arrangörerna av toppmötet i Washington D.C. De närmare femhundra deltagarna ägnar merparten av den första dagen åt en mer grundläggande fråga: Även om det går – varför göra det? Vad är poängen?
Under en frågestund reser sig en ung kvinna bland åhörarna och går fram till ett mikrofonstativ nedanför scenen. Hon berättar att hennes son föddes med en dödlig sjukdom. Rösten stockar sig.
– Han blev sex dagar gammal och led varje dag. Han hade kramper varje dag. Om ni har den kompetens och kunskap som krävs för att bota de här sjukdomarna, så för helsicke gör det. Det var allt.
Hon får en lång applåd.
Näste talare är Eric Lander, genetikprofessor vid Harvard university och vetenskaplig rådgivare åt USA:s president Barack Obama. Hans budskap är att en genteknisk förändring av mänsklig arvsmassa som går i arv till kommande generationer bara kan vara försvarlig i extremt sällsynta fall.
Förändringar som inte går i arv är en annan femma. Försök med så kallad somatisk genterapi har pågått i decennier. Ny teknik för att redigera arvsmassan har gett draghjälp åt forskningen.
I november förra året räddade läkare i London livet på en ettårig flicka med leukemi genom att använda en metod som påminner om Crispr till att redigera arvsmassan hos donerade immunceller så att de fungerade i hennes kropp. På liknande sätt försöker forskare även bota hiv, cancer, blödarsjuka och flera andra sjukdomar.
Gemensamt för sådana behandlingar är att de enbart påverkar celler i patientens kropp – inte arvsmassan hos kommande generationer. Men ämnet för mötet i Washington är alltså genförändringar som går i arv.
– Att åstadkomma ärftliga genförändringar är inte den första, andra eller tredje saken vi bör tänka på om vi verkligen bryr oss om att undvika genetiska sjukdomar, säger Eric Lander.
Hans främsta argument är praktiskt. Hjärt- kärlsjukdomar, cancer, psykisk ohälsa och andra vanliga sjukdomar är kopplade till mängder av ärftliga riskfaktorer. Där kan inte ens den hyllade Crispr-tekniken ställa allt till rätta. Dessutom är biologin komplicerad. En gen som ökar risken för en viss sjukdom med några procent kan på ett ännu okänt sätt skydda mot en annan. Därmed kan ett redigeringsförsök göra mer skada än nytta.
Ett annat argument handlar om alternativ. Det finns ärftliga sjukdomar som beror på en enda trasig gen. Sådana sjukdomar går i de flesta fall att undvika genom att välja ut genetiskt friska ägg i samband med en provrörsbefruktning.
Men det finns undantag. Några dussin människor i världen har dubbla anlag för Huntingtons sjukdom, som är obotlig och leder till döden. Om en sådan person vill bli biologisk förälder kommer barnet garanterat att få sjukdomen. Samma sak gäller människor med dubbel uppsättning av dominanta anlag för ännu mer sällsynta sjukdomar.
– Där skulle genredigering vara användbar, säger Eric Lander.
Han vill alltså inte helt utesluta genförändringar som går i arv, även om han anser att det bara skulle kunna vara motiverat i extremt sällsynta fall.
Andra talare påpekar att det redan nu finns kliniker runt om i världen som erbjuder dyra behandlingar med stamceller mot allt från autism till övervikt. Det vetenskapliga stödet är svagt eller obefintligt. På motsvarande sätt skulle mindre nogräknade fertilitetskliniker kunna erbjuda blivande föräldrar en Crispr-behandling i syfte att ge barnet önskade egenskaper, till exempel en viss hud- och ögonfärg.
– Sådana avarter kan skada den seriösa forskningen, säger genetikern Staffan Normark, som besöker Washington som representant för Kungliga Vetenskapsakademien.
Han menar att en negativ opinion skulle kunna leda till krav på förbud även mot lovande och viktiga försök att bota cancer och andra sjukdomar med somatisk genterapi, som alltså inte påverkar kommande generationer.
David Baltimore och de andra arrangörerna är inne på samma linje. På mötets sista dag slår de fast att klinisk forskning med icke-ärftlig genredigering måste vara tillåten, liksom forskning som går ut på att redigera arvsmassan hos mänskliga embryon – men inte implantering av ett sådant embryo i en kvinna.
I Sverige har den regionala etikprövningsnämnden i Stockholm samma uppfattning. I somras gav den grönt ljus åt försök att redigera arvsmassan hos mänskliga embryon.
– Syftet är att utforska biologiska processer under den tidiga utvecklingen, säger Fredrik Lanner, som forskar i embryonal utveckling vid Karolinska institutet i Solna.
Han hoppas att påbörja försöken senare i år.

Kunskap baserad på vetenskap
Prenumerera på Forskning & Framsteg!
Inlogg på fof.se • Tidning • Arkiv med tidigare nummer
Nyligen fick brittiska forskare tillstånd att göra liknande experiment. I både Sverige och Storbritannien kommer samtliga genförändrade embryon att förstöras inom en vecka.
Dokumentet från Washington tar avstånd från att genförändra människor – med ett tillägg om att saker och ting kan ändra sig: ”I takt med att den vetenskapliga kunskapen och samhällets värderingar utvecklas bör frågan om klinisk användning av genredigering av könsceller regelbundet ses över.”
I Sverige och många andra länder är det redan förbjudet att genförändra människor. Det återstår förstås att se vilket genomslag som rekommendationerna får på andra håll. Mycket har förändrats sedan mötet i Asilomar för fyrtio år sedan. Den tidens banbrytande genetiska verktyg fanns i ett fåtal universitetslaboratorier, främst i USA. I dag går det att på nätet beställa utrustning som behövs för att arbeta med Crispr.
I mitten av 1970-talet fanns varken patent eller företag baserade på dna. Nu är gentekniken inlemmad i en stor och lönsam industri.
– Det var nog lättare att få gehör för ett moratorium för fyrtio år sedan, säger Göran Hermerén, professor emeritus i medicinsk etik vid Lunds universitet och sakkunnig i Statens medicinsk-etiska råd.
Han menar att den främsta nyttan med toppmötet om genförändrade människor är att det kan bidra till en seriös diskussion. På den punkten är mötet lyckat, inte minst på grund av kloka och oväntade frågor från publiken.
Under en av de många paneldiskussionerna ställer en ung man med hipsterskägg en fråga till experterna uppe på scenen:
– Har ni funderat på om en person som har fått sin arvsmassa redigerad borde berätta det för en potentiell partner?
I strålkastarljuset sitter fem ytterst kompetenta professorer i juridik, etik och biologi i var sin fåtölj. De tittar på varandra. Frågan gäller om man ska bli förvarnad om att man eventuellt kan bli förälder till ett gmo-barn. Efter en kort tystnad svarar Barbara Evans, juridikprofessor vid University of Houston:
– Det känns som en privatsak. Men din fråga visar att det finns sociala följder som vi inte ens har börjat tänka på. Om man går ut på en dejt, borde man säga: ’Förresten, jag har fått min arvsmassa redigerad’? Jag vet inte. Det kräver en hel del eftertanke.
Två genombrott och två viktiga möten
1974 Forskare i USA lyckas stoppa in en bit dna ifrån en groda i arvsmassa från en tarmbakterie. För första gången har biologer fogat samman dna från två vitt skilda arter.
1975 Experter träffas i Asilomar, Kalifornien, för att hitta sätt att hantera genteknikens tänkbara risker. De enas om att stoppa vissa experiment.
2012 Emmanuelle Charpentier vid Umeå universitet är en av forskarna bakom Crispr/Cas9 – en revolutionerande metod för att redigera arvsmassa.
2015 Med Crispr-tekniken är det tekniskt möjligt att genförändra människor. Under tre dagar i december diskuteras frågan vid ett vetenskapligt toppmöte i Washington D.C.
Lyckat försök på tvillingsystrar

Krabbmakakerna Ningning och Mingming bär på två ofarliga mutationer som kinesiska forskare förde in i befruktade ägg. Det visar att Crispr/Cas9 fungerar på primater. Men genförändringar kan hamna fel.
Genteknik botade Layla från cancer
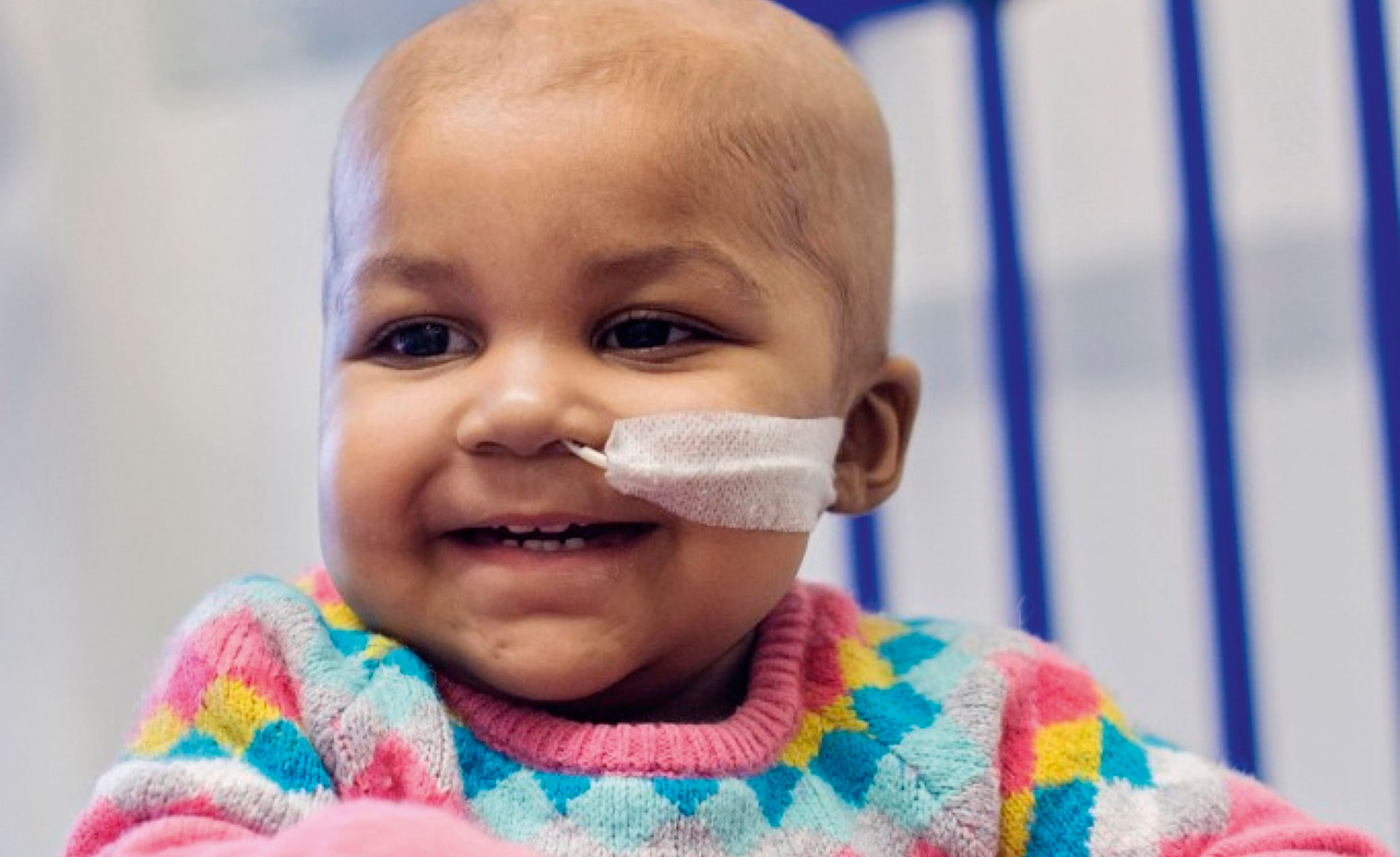
Ettåriga Layla räddades från leukemi av brittiska läkare, som behandlade henne med genetiskt ändrade immunceller från en donator. En sådan genförändring går inte i arv.










































