En tunntarm från en gris flyter i en skål med vätska. Det svarta till vänster är stygn i den vävnad som håller tarmen på plats i magen. Till höger syns själva tarmen. Organet ska rensas från celler och användas i ett experiment.
Bild: Maria Steén
Odlade organ kapar köerna till transplantation
Svenska kirurger har opererat in laboratorieodlade organ i patienter. Metoden kan bli en framtida lösning på organbristen.
[UPPDATERING: Sedan denna artikel skrevs har kirurgen Paolo Macchiarinis verksamhet – som beskrivs i slutet av artikeln – blivit starkt kritiserad. Flera av de patienter som fått en syntetisk luftstrupe har avlidit.]
[UPPDATERING: Sedan denna artikel skrevs har forskning som bedrivits av bland andra Suchitra Holgersson och Michael Olausson blivit starkt kritiserad. Centrala etikprövningsnämnden har gjort en granskning och skriver i ett yttrande att den anser att de är skyldiga till oredlighet i forskning.]
Femåriga Isabel Dickhoff lägger sig vant till rätta på undersökningsbritsen i det lilla rummet på Drottning Silvias barnsjukhus i Göteborg. Hon har gjort oräkneliga ultraljudsundersökningar det senaste året. När sköterskan frågar efter hennes personnummer hinner Isabel före pappa Joakim och räknar utan att tveka upp sina tio siffror. Hon drar upp tröjan och visar ärret på magen. Ärret, som påminner om ett Mercedesmärke fast utan ringen, har läkt ihop fint efter operationen för ett halvår sedan. Det var i slutet av maj förra året som Isabel fick hög feber. När febern efter flera dagar fortfarande inte hade gått ner, sökte de vård. Läkaren som undersökte Isabel kände att mjälten var förstorad och tog blodprover, men kunde inte säga vad som var fel.
Klockan tre samma natt väcktes Isabels föräldrar av ett telefonsamtal från sjukhuset. Svaren på blodprovsanalyserna hade kommit.
– De trodde att Isabel hade leukemi. Vi åkte till Göteborg tidigt nästa morgon. Där tog de en massa prover, bland annat på benmärgen, säger Joakim Dickhoff, som är Isabels pappa.
Benmärgsprovet visade att det inte rörde sig om cancer i blodet, utan något annat. Läkarna kom fram till att det var stopp i portavenen, ett stort blodkärl som leder blodet från mag-tarmsystemet och mjälten in i levern. Förträngningen gjorde att trycket i andra kärl blev för högt, vilket hade lett till att mjälten förstorats och bråck hade bildats på blodkärl i magsäcken och matstrupen.
– Det går inte att leva med det hur länge som helst. Om bråcken spricker är det farligt, så läkarna var tvungna att leda blodet till levern på något sätt, säger Joakim Dickhoff.
Vid den operation som Isabel behövde är det ibland möjligt att använda ett av patientens egna blodkärl. Joakim var också beredd att donera en bit av sin lever till sin dotter om det skulle visa sig att hennes lever hade tagit för mycket skada. Han var färdigutredd som donator inför operationen. Levertransplantation var det sista alternativet, om inget annat fungerade. Men så fanns också ett nytt alternativ – att använda en odlad ven. Ett team av läkare och forskare vid Sahlgrenska universitetssjukhuset i Göteborg hade gjort det en gång förut på en flicka med stopp i portavenen. Isabels föräldrar tyckte att det var bra att ha ytterligare ett alternativ, så forskarna gjorde i ordning en odlad ven som fanns till hands om den skulle behövas.
Isabel Dickhoffs operation gjordes i oktober förra året. Den tog flera timmar.
– Jag var på helspänn hela tiden. När kirurgen, Michael Olausson, kom ut och sade att operationen hade gått bra och levern såg frisk ut, då kändes det väldigt bra. Jag har nog aldrig blivit så glad förut i hela mitt liv, säger Joakim Dickhoff.
Eftersom det inte hade gått att använda Isabels egna blodkärl, transplanterade läkarna dit den odlade venen. Efter operationen mådde hon snabbt bättre.
– Före operationen hade Isabel dåligt immunförsvar, så när hon blev sjuk blev hon aldrig riktigt frisk igen. Hon var väldigt trött. Efter transplantationen har många värden blivit mer eller mindre normala igen och hon står emot förkylningar. Hon är betydligt mycket piggare. Förut när vi gick på stan fick jag ofta bära henne. Nu är det hon som springer framför mig hela tiden, berättar Joakim Dickhoff.
Ultraljudsundersökningen av blodkärlet är klar för den här gången. Sköterskan håller fram en låda med färgglada barntatueringar och Isabel får välja två innan hon går. Det blir en fjäril och en dinosaurie. Sedan skuttar hon före pappa ut i sjukhuskorridoren så att klappret från hennes vita skor ekar mot väggarna.
Isabels transplantation är ett exempel på hur den regenerativa medicinen har tagit klivet från laboratorium till klinik. Målet är att reparera, ersätta eller återskapa vävnader och organ. Sverige är ett av de länder som ligger långt framme. Både vid Sahlgrenska i Göteborg och vid Karolinska institutet i Stockholm forskas det intensivt om hur man kan skapa eller modifiera organ utanför kroppen, och därefter transplantera dem till patienter. Metoden är en experimentell behandling som har prövats i mindre skala på patienter. – Vid transplantation är ett av problemen att mottagarens kropp kan stöta bort organet. Men ett ännu större problem är bristen på organdonatorer. Vi funderade på vad vi kan göra för att öka poolen med tillgängliga organ för transplantation och frågade oss själva: Kan man bygga ett organ på labb? säger Suchitra Holgersson, professor i transplantationsbiologi vid Sahlgrenska akademin.
Sedan år 2008 har hon satt upp ett forskningslabb i nära samarbete med bland annat Michael Olausson, överläkare vid Transplantationscentrum på Sahlgrenska universitetssjukhuset. Suchitra Holgersson och hennes forskargrupp arbetar med flera olika organ och vävnader, som de hoppas ska kunna komma till nytta för patienter i framtiden.
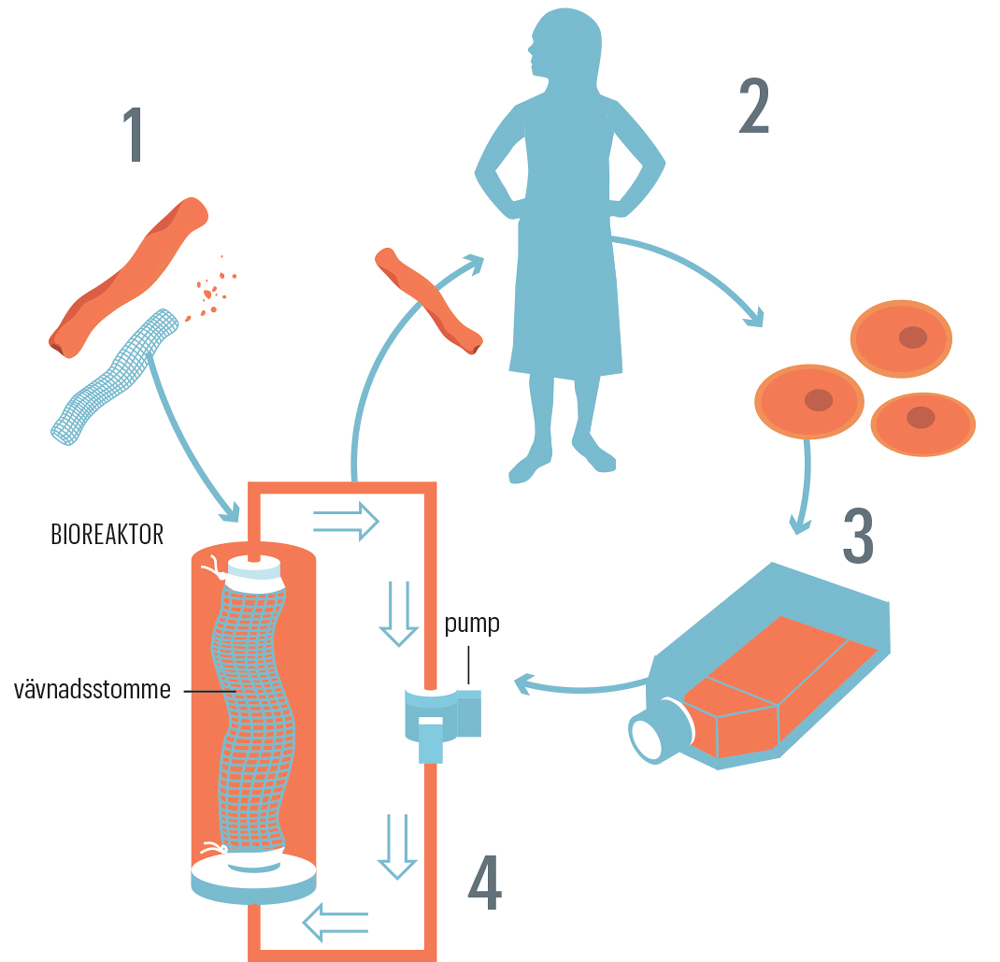
– Har någon flyttat grishjärtana från kylen? undrar hon medan hon lyfter på plastburkar som står staplade på varandra i kylskåpet på forskningslabbet. I en glasflaska med blått lock finns en mjölkvit, tunn fosterhinna, som efter förlossningen skänkts till forskning. I en plastburk flyter artärer runt i en rosa vätska, i en annan ligger ett struphuvud från en gris. De flesta organen är spöklikt vita efter att ha tvättats noga, men en mänsklig njure i en av burkarna har fortfarande kvar sin blekbruna färg och gult sladdrigt fett fäst på ytan. I sin forskning om odlade organ utgår Suchitra Holgersson från det som naturen erbjuder – därav samlingen av vävnader och organ i kylskåpet. Hon berättar att det behövs tre saker för att odla ett organ utanför kroppen. Det första är en tredimensionell struktur i samma form som organet ska få: antingen ett existerande organ eller en form tillverkad av ett biokompatibelt material. När ett befintligt organ används tvättas cellerna bort med olika vätskor. Till sist är bara en stödstruktur bestående av ett nätverk av proteiner, det så kallade extracellulära matrix, kvar. Det andra som behövs är celler från patienten som ska få organet. Så kallade stamceller utmärks av att de kan mogna ut, eller differentiera, till flera olika typer av specialiserade celler. Forskarna prövar olika sorters stamceller för att hitta rätt typ för olika organ.
Sist men inte minst behövs en så kallad bioreaktor med rätt näringsämnen, temperatur och miljö där cellerna trivs. Cellerna får fästa till organstommen och fylla ut alla hålrummen. Efter någon vecka kan organet förhoppningsvis transplanteras till patienten och fungera lika bra som frisk vävnad. Eftersom organet nu består av patientens egna celler minimeras risken för avstötning. – Det är en stor fördel om vi i framtiden kan odla organ med patientens egna stamceller. Patienterna som vi har transplanterat nu har inte behövt ta immunhämmande mediciner, vilket är bra att slippa eftersom medicinerna kan ge många biverkningar, säger Suchitra Holgersson.
Ett nytt blodkärl av stamceller på en stomme
Bild: Johan Jarnestad
Det finns förstås många frågetecken att räta ut innan odlade organ kan bli ett standardalternativ på sjukhusen. En sådan fråga handlar om vilka stamceller som är lämpliga att använda och vad som händer när man flyttar stamceller till nya platser i kroppen. Det finns flera sorters stamceller med regenerativ förmåga. Några av dem är mer kontroversiella än andra att använda i forskning och klinisk användning, till exempel embryonala stamceller från tidiga foster. Det är även möjligt att framställa inducerade pluripotenta stamceller genom genetisk manipulation, en teknik som belönades med förra årets Nobelpris i medicin eller fysiologi. En del forskare har uttryckt oro för att embryonala stamceller och inducerade pluripotenta stamceller skulle kunna förändras och bli cancerceller om de används i människor. Det är hittills inte klarlagt om risken för cancer ökar när man använder patientens egna celler för odlade organ. – Eftersom vi använder ganska differentierade celler tror vi inte det, men vi vet inte säkert ännu. Vi har inte sett några problem med den första patienten som transplanterades för två år sedan, säger Suchitra Holgersson. Hon menar att en mycket viktig del i arbetet är att genomföra kliniska studier i större skala för att visa om tillvägagångssättet är säkert och vilka långtidseffekterna är. – Så fort man tar celler från kroppen finns det en risk att de kan förändras, så är det. Genom att vara försiktiga och göra många analyser för att kontrollera att det inte finns cellulära förändringar innan man sätter tillbaka cellerna i kroppen, försöker vi undvika den risken, fortsätter hon.
När det gäller den tredimensionella stödstrukturen som cellerna får växa i använder Suchitra Holgerssons grupp befintliga vävnader.
– Fördelen med det är att hela den komplicerade strukturen redan finns där, med nerver och blodkärl. I extracellulära matrix finns proteiner och tillväxtfaktorer som cellerna är vana vid. Man kan aldrig få samma miljö med artificiella material.
Förutom att behandla tre barn med odlade vener har gruppen också bidragit till transplantation av en luftstrupe. En 76-årig man som i unga år skadat luftstrupen i ett högt fall har fått en ny luftstrupe som klätts med hans egna celler.
– Alla cellager återbildades – nerver, muskler, allt! Kroppen tar över efter transplantationen och gör resten av arbetet, säger Suchitra Holgersson.
Medan Suchitra Holgerssons grupp arbetar med befintliga vävnader som stomme för de odlade organen, finns det andra forskare som har riktat in sig på att utveckla artificiella stödstrukturer. En av dem är Paolo Macchiarini, gästprofessor i regenerativ kirurgi vid Karolinska institutet. Han är jetlaggad efter att just ha kommit hem från USA. Där var han chefskirurg i ett team som genomfört den första transplantationen av en odlad luftstrupe på ett barn. Flickan föddes utan luftstrupe. Sedan födseln har hon vårdats på en intensivvårdsavdelning under nästan tre år.
– Målet med transplantationen var att rädda hennes liv. De här barnen dör tyvärr annars, säger Paolo Macchiarini.
Han berättar att operationen var mycket komplicerad. Förutom avsaknaden av luftstrupe hade flickan även andra missbildningar i blodkärl och matstrupen. Den nio timmar långa operationen, som genomfördes vid Children’s hospital of Illinois, gick dock bra.
– Flickan återhämtar sig väldigt bra från operationen, men nu behöver hon lära sig en massa nya saker. För henne var det en helt ny sak att andas själv, hon vet inte hur man gör utan måste lära sig det. Nu upptäcker hon smak och lukt. Det är ett barn som nästan blir som en nyfödd igen. Hon upptäcker en helt ny dimension av livet, säger Paolo Macchiarini.
Luftstrupen till den lilla flickan skapades från grunden av syntetiskt, biokompatibelt material, liknande de som använts vid fem tidigare transplantationer på vuxna patienter. Paolo Macchiarini har även genomfört nio transplantationer med odlade luftstrupar där man utgått från donerade luftstrupar från människor. Men en viktig sak skilde den här transplantationen från alla de tidigare.
– Jag blev mycket överraskad av den extraordinära förmågan hos barn att regenerera vävnad. På den fjärde dagen efter transplantationen undersökte vi luftstrupen och såg att de omogna stamcellerna hade specialiserat sig. Hos vuxna ser vi samma sak efter ungefär sex till tolv månader. Jag förväntade mig inte detta, så det har fått mig att tänka om. Jag tror att den bästa gruppen av patienter är barn, för kroppens kapacitet att återskapa vävnad är så obegränsad hos barn jämfört med äldre patienter. Jag blev väldigt glad, det var en underbar överraskning att upptäcka det, säger Paolo Macchiarini.
Det finns flera skäl till att Paolo Macchiarinis forskargrupp arbetar mycket med konstgjorda stödstrukturer. Han säger att han inte har övergett tanken på att utgå från biologisk vävnad, men att det är ett problem att vara beroende av en organdonation.
– Vi får allt fler förfrågningar om att behandla patienter med svår cancer. Då kan vi inte vänta. En donation kan komma i dag eller i morgon, men det kan också dröja sex månader, säger Paolo Macchiarini.
Bristen på organ är ett problem världen över. I Sverige koordineras organdonationer på nationell nivå, men många andra länder saknar program för att på ett kontrollerat sätt ta till vara organ från människor som vill donera efter sin död. Han menar att artificiella stödstrukturer kan vara en lösning:
– Förr eller senare kommer dessa konstgjorda organ att finnas tillgängliga för tillverkning i större skala. Det är ingen mening med att lägga alla dessa pengar på forskning om vi inte gör det så enkelt som möjligt, så att hela världen kan använda det.
[UPPDATERING: Sedan denna artikel skrevs har kirurgen Paolo Macchiarinis verksamhet blivit starkt kritiserad. Flera av de patienter som fått en syntetisk luftstrupe har avlidit, då luftstrupen aldrig läkt ihop med kroppen. Fallet som beskrivs här ovan, där han opererade en flicka vid Children’s hospital of Illinois, slutade med att flickan dog den 6 juli 2013.]
[UPPDATERING: Sedan denna artikel skrevs har forskning som bedrivits av bland andra Suchitra Holgersson och Michael Olausson blivit starkt kritiserad. Centrala etikprövningsnämnden har gjort en granskning och skriver i ett yttrande att den anser att de är skyldiga till oredlighet i forskning.]
Omklädd njure producerade urin
Nyligen lyckades amerikanska forskare få en odlad råttnjure att fungera, enligt en studie som publicerades i Nature Medicine. Forskarna utgick från en råttnjure, som de tvättade bort alla celler från. Sedan lät de en vätska innehållande mänskliga endotelceller skölja genom njurens blodkärl och genom urinledaren tillförde de njurceller från nyfödda råttungar.
När forskarna transplanterade in den återskapade njuren i en råtta som bara hade en njure, kunde det odlade organet producera urin så fort blodet började filtreras genom njuren. Även om kapaciteten hos den odlade njuren var märkbart sämre än hos ett friskt organ, hoppas forskarna vid Massachusetts general hospital kunna förbättra metoden så att odlade njurar i framtiden ska kunna ersätta en sjuk njure hos människor.