Bild: Annika af Klercker & SPL
För första gången tillåts en behandling som går i arv
Félicia Adlersfeld förlorade synen på grund av en mutation i mitokondrierna – cellernas kraftverk. Många andra drabbas ännu hårdare. Nu har det brittiska parlamentet röstat ja till en metod som hindrar sådana sjukdomar från att gå i arv till nya generationer. Men i Sverige är metoden fortfarande olaglig.
En morgon när Félicia Adlersfeld stod framför badrumsspegeln och blundade med höger öga för att lägga på mascara upptäckte hon ett hål i synfältet. Allt var skarpt utom just det hon försökte fokusera på.
Hon bokade tid hos en optiker. Där skulle hon blunda med höger öga och säga vilken rad hon kunde läsa på en syntavla.
– Jag såg allting i rummet, förutom tavlan. Den var helt tom, säger Félicia Adlersfeld.
Sedan följde månader med magnetröntgen, EEG, blodprover och massor av andra undersökningar. Hela tiden växte hålet i synfältet. Till slut kom diagnosen: Lebers hereditära optikusneuropati (LHON).
Sjukdomen är mycket ovanlig. Den drabbar unga människor och slår ut synen utom i synfältets yttersta delar.
Det var vår. Félicia Adlersfeld skulle snart fylla 21. På hösten samma år drabbades det andra ögat. Hon var ute med sin pitbullterrier Simba när det plingade i mobilen. Hon fick ett sms men kunde inte läsa texten hur hon än försökte.
– Det kändes som om livet var slut just när det skulle börja.
Ögonsjukdomen LHON är ärftlig och beror på en skada i mitokondrierna, ett slags kraftverk inuti kroppens celler.
De livsviktiga mitokondrierna påminner om bakterier. De omvandlar energi från maten vi äter till den typ av bränsle som cellerna behöver.
Mitokondrierna har sin egen lilla arvsmassa, men måste ha hjälp från ytterligare gener i cellkärnan för att klara sitt jobb. En enda kroppscell kan innehålla ett par tusen mitokondrier. Hos en genomsnittlig person väger de tillsammans uppåt ett par kilo.
Forskarna har beskrivit över hundra sjukdomar och syndrom som beror på att mitokondrierna inte fungerar som de ska. Dessa drabbar i första hand energislukande organ som hjärnan, musklerna och njurarna.
Den vanligaste orsaken är att någon av de hjälpande generna i cellkärnan har gått sönder. Men i ungefär en fjärdedel av fallen är orsaken en mutation i någon av mitokondriens egna gener. Sådana sjukdomar ärvs enbart på mödernet, eftersom alla människor får sina mitokondrier från sin mamma.
Barn kan drabbas hårt. Vissa sjukdomar är dödliga redan i fosterstadiet och leder till missfall. Andra visar sig under de första åren i form av mer eller mindre svåra problem med muskelförtvining, hormonrubbningar och hjärnskador som orsakar kramper och utvecklingsstörning.
Det går att lindra vissa symtom, men det finns ingen bot.
– Jag träffar barn som varit fullt friska men stannar av i utvecklingen, tappar färdigheter och dör i tidiga barnaår, säger Karin Naess, barnneurolog vid Karolinska universitetssjukhuset.
Mitokondriesjukdomar som visar sig hos vuxna är lindrigare och symtomen mer specifika. Det gäller även LHON. Félicia Adlersfeld har haft diagnosen i åtta år nu.
– När det hände grät jag i typ tre dagar. Sedan tänkte jag: det här är mitt liv. Det här är den giv jag har fått, och då får jag se till att spela korten så bra det går.
Hon lärde sig punktskrift och – framför allt – att använda datorer med talsyntes, och att utnyttja sitt perifera seende. Tack vare tekniska hjälpmedel och en enorm envishet kompletterade hon sin frisörutbildning med kurser på komvux, och tog sig igenom socionomlinjen på Stockholms universitet. Numera har hon fast jobb på kommunen.
Vi sitter i en svart skinnsoffa i lägenheten norr om Stockholm där hon bor med sin man Patrick, som är på jobbet. Hunden Simba ligger under bordet. Han rycker till av ett pling i mattes mobil. Félicia förstorar ett sms och håller skärmen i ögonvrån. Hon ler.
– Det var från min man. Lite kärlek bara.
De gifte sig i januari, vid solnedgången på en strand på Hawaii.
– Ända sedan jag fick diagnosen har jag tänkt jättemycket på det här med barn. Jag vet att jag har något som ärvs på mödernet, och det är ett visst ansvar, säger hon.
Läkarna säger att chansen att ett barn slipper en synskada är betydligt större än att det påverkas av mutationen. Hur hanterar man ett sådant besked? Ett liv med nedsatt syn kan såklart vara rikt och fullt av kärlek.
Men längtan efter barn väcker många tankar – om folks åsikter, om nya behandlingar som kan tänkas dyka upp i framtiden. Och om att adoptera eller använda ägg från en donator utan anlag för en mitokondriesjukdom.
– Jag har full respekt för dem som väljer det, men för mig känns inte det som ett alternativ, säger Félicia Adlersfeld.
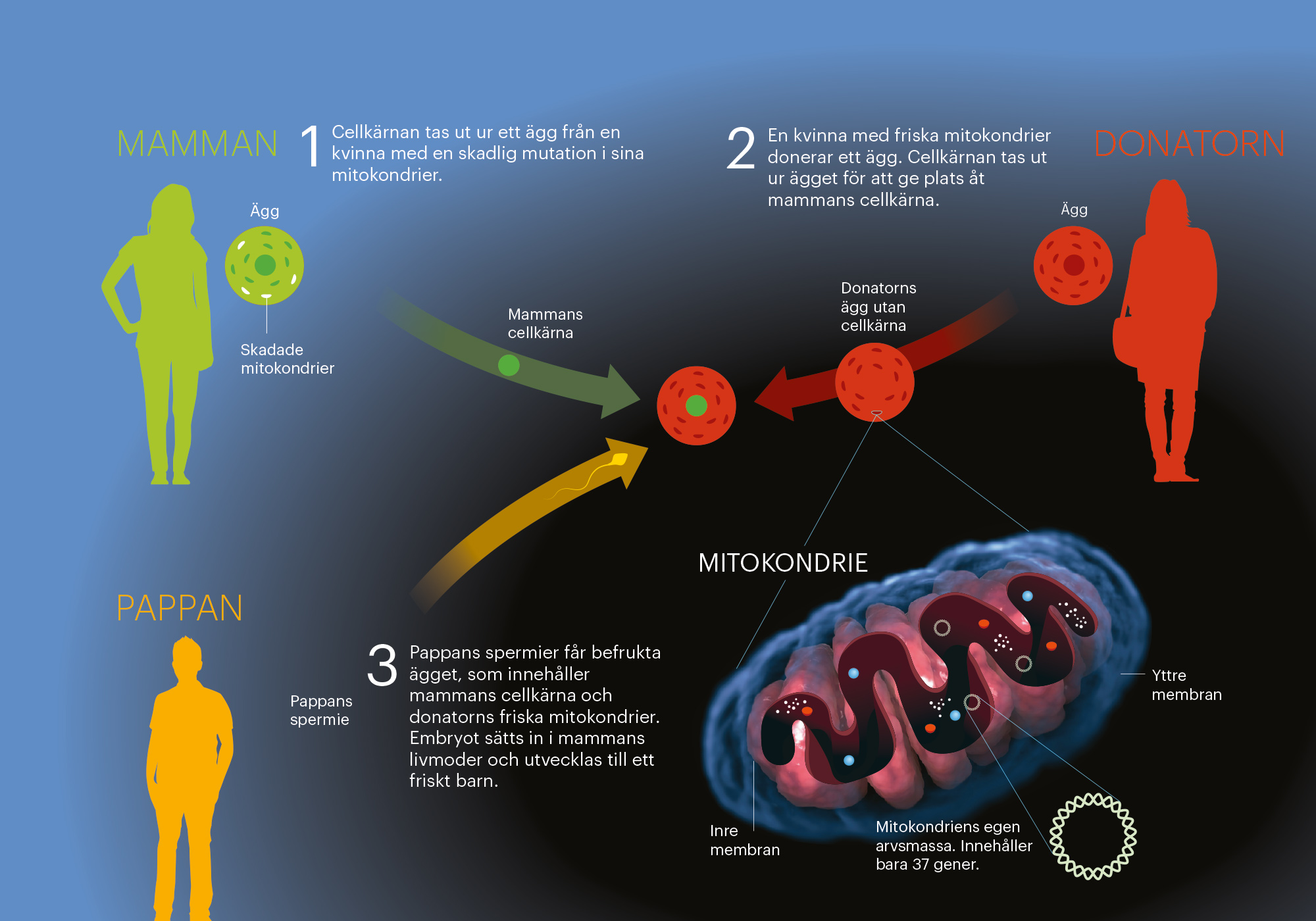
Bild: Johan Jarnestad
Och så mitt i alltihopa: ett avgörande beslut i det brittiska parlamentet. Det gäller en metod som bryter mitokondriernas arvslinje mellan mor och barn.
Det går att transplantera cellkärnan från ett ägg med skadade mitokondrier till ett donerat ägg med friska. I en kvinnas livmoder skulle ett sådant ägg kunna utvecklas till ett barn med mitokondrier från donatorn. På så vis kan skadade mitokondrier försvinna ur drabbade familjer för all framtid.
Tekniken har visat sig fungera på möss och apor. Mitokondriebyten har även gjorts på både obefruktade och befruktade människoägg, men än så länge har inget barn fötts efter ett sådant byte.
Efter närmare ett decennium av debatter och etiska utredningar röstade det brittiska parlamentets båda kammare i februari ja till världens första lag som uttryckligen tillåter mitokondriebyten. När lagen träder i kraft i höst kan brittiska läkare ansöka om tillstånd hos Human fertilisation and embryology authority för att använda metoden. Verksamheten kommer att börja i liten skala. Alla barn ska följas noga för att hitta eventuella komplikationer.
Att Storbritannien har kommit längst i fråga om mitokondriebyten beror på att några av de världsledande forskarna inom området finns vid Newcastle university i norra England. Storbritannien har sedan länge en stark forskningstradition inom fertilitetsteknik. Världens första ”provrörsbarn”, Louise Brown, föddes i Storbritannien år 1978 – vilket på sin tid utlöste en storm av protester och farhågor om allvarliga medicinska risker.
Par i Sverige kommer att kunna resa till Storbritannien och söka hjälp på kliniker som erbjuder mitokondriebyten, ungefär som ensamstående kvinnor i dag kan resa till Danmark för att få en insemination.
Men i Sverige råder förbud. Att ändra arvsmassan i mänskliga könsceller eller befruktade ägg strider mot lagen om genetisk integritet. Man får helt enkelt inte mixtra med människans biologiska arv. Intressant i sammanhanget är att förarbetena till lagen diskuterar ett undantag för just mitokondriebyten.
Ledamöterna i Statens medicinsk-etiska råd (Smer) har grubblat över frågan utan att kunna komma överens. En majoritet av dem säger nej till metoden i dag, men är öppna för att den kan få användas i Sverige om forskarna tar fram säkrare belägg för att de medicinska riskerna är små, enligt en rapport publicerad för drygt ett år sedan.
– Främst behövs fler djurförsök för att kartlägga riskerna för kromosomavvikelser och andra missbildningar, säger Kjell Asplund, ordförande för Smer.
Chatrine Pålsson Ahlgren, ledamot i Smer och kristdemokrat, har en annan syn på saken. Hon skulle säga nej till mitokondriebyten även om man säkert visste att metoden utan några som helst medicinska risker utrotar dödliga eller plågsamma sjukdomar för gott.
– Vi ska inte manipulera människan. Det blir ett sluttande plan. Jag ser framför mig en elitmänniska som ska odlas fram. Det vill jag inte vara med om, säger hon.
Hon fruktar att det första mitokondriebytet även blir ett första steg mot alla möjliga försök att skräddarsy människors egenskaper med genteknik. Brittiska kritiker talar om designer babies.
Kjell Asplund tror inte på en sådan utveckling. Att byta ut en naturligt förekommande variant av mitokondrier mot en annan i syfte att förebygga svåra sjukdomar är något helt annat än att klippa och klistra i kromosomer för att få extra snygga, starka och smarta barn.
– Vi har inte sagt ja till att manipulera det genetiska materialet i kärnan, säger han.
Cellkärnan innehåller över 20 000 gener som bestämmer hur våra proteiner ska se ut. Där finns genetisk information som påverkar ögonfärg, längd, intelligens och andra mer eller mindre biologiskt ärftliga egenskaper.
Mitokondrierna har sammanlagt 37 gener, men bara 13 av dem kodar för proteiner. Deras enda kända uppgift är att framställa bränsle (adenosintrifosfat) åt cellens kemiska maskineri.
För att klara sitt jobb behöver mitokondrierna dessutom hjälp av drygt hundra gener i cellkärnan. Det betyder att den som till äventyrs vill odla fram en ”elitmänniska” har små chanser att lyckas genom ett mitokondriebyte.
En människa som utvecklas ur ett embryo med transplanterade mitokondrier kommer att ha dna från tre personer: mamman, pappan och donatorn. Därför påstås det ibland att han eller hon skulle ha tre föräldrar.
– Det stämmer inte alls, säger Outi Hovatta, fertilitetsläkare och professor i obstetrik och gynekologi, Karolinska institutet i Huddinge.
Hos en människa finns över 99,99 procent av den genetiska informationen i cellkärnan, som är ett arv från mamman och pappan. Den rimliga slutsatsen blir att den som blir till efter ett mitokondriebyte har två föräldrar, inte tre. Det anser både Statens medicinsk-etiska råd och motsvarande etikråd i Storbritannien. I praktiken betyder det bland annat att barnet aldrig kan få rätt att ärva donatorns pengar, eller ens få veta vem hon är.
Forskare bedömer att en person av ungefär 10 000 har en sjukdom som gått i arv via mitokondrierna. Hos vissa är samtliga mitokondrier skadade. Men friska och skadade mitokondrier kan finnas sida vid sida i samma cell.
Risken att bli sjuk beror både på hur mutationen ser ut och på hur stor andel av mitokondrierna som är skadade – andelen skadade mitokondrier kan dessutom variera i olika vävnader i kroppen. Därför kan en kvinna med låg andel skadade mitokondrier vara frisk, men ändå föda barn med en hög andel och svår sjukdom.
Blandningen av normala och skadade mitokondrier innebär också att en gravid kvinna, som vill använda fosterdiagnostik för att få veta om hennes barn kommer att drabbas, inte kan räkna med något säkert besked.
Karin Naess, som träffar sjuka barn och deras anhöriga, är positiv till det brittiska beslutet. Och hon hoppas att metoden så småningom också kommer till Sverige.
– Det rör sig om ytterst få fall. Gissningsvis några enstaka per år, säger hon.
Den ansvariga myndigheten i Storbritannien har ännu inte bestämt vilka som ska stå först i kön till ett mitokondriebyte, men troligen blir det kvinnor som bär på anlag för svårt handikappande eller dödliga mitokondriesjukdomar.
Så hur blir det med ögonsjukdomen LHON?
– Man kommer förstås att diskutera en utökad användning. Jag kan inte säga var gränsen ska gå, säger Karin Naess.
Félicia Adlersfeld ser mitokondriebyten som en framtida möjlighet, men har inte riktigt hunnit sätta sig in i detaljerna och de eventuella riskerna för biverkningar.
Faktum är att det redan finns människor med transplanterade mitokondrier. Dock inte för att förebygga någon ärftlig sjukdom.
För drygt 15 år sedan testade läkare vid en fertilitetsklinik i USA en variant av den vanliga provrörstekniken. De sög ut en del av innehållet i ett friskt mänskligt ägg, och sprutade in vätskan i ägg från en kvinna som inte blivit gravid efter tidigare försök. Tanken var att den extra cellvätskan – inklusive dess mitokondrier – skulle öka chansen för en graviditet.
Minst 30 barn har fötts efter ett sådant ingrepp. Några har en blandning av mitokondrier från sin mamma och en donator, och är därmed de första människorna i världen med konstgjorda förändringar i arvsmassan som kan gå i arv.
Ingreppet – som skedde bara några år efter kloningen av fåret Dolly – blev så omstritt att det förbjöds. Det fanns också misstankar om en ökad risk för kromosomskador.
Den typ av mitokondriebyten som det brittiska parlamentet nu har godkänt ger inga sådana biverkningar i djurförsök, enligt Shoukhrat Mitalipov, chef för ett centrum för forskning om embryonala celler och genterapi vid Oregon health & science university i USA.
– Om samma sak även gäller för människor vet vi först när vi har testat, säger han.
Shoukhrat Mitalipovs forskargrupp är världsledande när det gäller mitokondriebyten på apor. I april 2009 föddes rhesusaporna Mito och Tracker efter ett mitokondriebyte i hans laboratorium. Sedan dess har ytterligare tre apor blivit till på samma sätt. Samtliga är friska och fullt normala, enligt Shoukhrat Mitalipov.
Nu har han sökt tillstånd från den amerikanska läkemedelsmyndigheten FDA för att få använda metoden på människor, och hoppas att det brittiska beslutet ökar chanserna för ett ja.
Till att börja med vill han försöka hjälpa barnlängtande kvinnor med anlag för svåra mitokondriesjukdomar som slår till tidigt. Men han anser att tekniken även bör få användas för att förebygga LHON, som drabbar synen.
– Om det finns en behandling som fungerar så tycker jag att alla har rätt till den, oavsett vilken mutation man har i sina mitokondrier, säger Shoukhrat Mitalipov.
Dessutom vill han se om metoden kan öka äldre kvinnors chanser att föda ett barn. Till skillnad från dagens alternativ – adoption eller äggdonation – skulle ett mitokondriebyte innebära att kvinnan blir biologisk mamma till sitt barn. Efterfrågan kan bli stor med tanke på att många kvinnor väntar länge med att försöka bli gravida.
Men frågan är omstridd. Infertilitet vid hög ålder är något annat än ärftliga mitokondriesjukdomar. Med all säkerhet kommer medicinska etiker att fortsätta diskutera mitokondrier under lång tid framöver.
Félicia Adlersfeld grubblar också en hel del. Bit för bit har hon återerövrat ett rikt liv med de mitokondrier hon har. För ett och ett halvt år sedan gick hon från Stockholm till Västervik, 30 mil, med Simba som enda sällskap. Telefonens gps och röstsyntes visade vägen.
– Jag ville bevisa för mig själv att det var möjligt, och kanske inspirera andra.
Den syn hon har kvar har hon lärt sig utnyttja maximalt – bland annat till att måla ögonfransarna vid festliga tillfällen. I många år har hon också tagit hand om sin guddotter varannan helg.
– Det började när hon var drygt två, och det går hur bra som helst. Det har stärkt mitt självförtroende mycket när det gäller att ha hand om barn, fast jag har en synskada, säger Félicia Adlersfeld.
Utvecklingen i Storbritannien har lett till nya funderingar över vad man kan, eller bör, göra för att försöka få ett friskt barn. Men i röran av invecklade frågor har Félicia Adlersfeld åtminstone ett par tydliga utgångspunkter: en bra relation med den man hon vill ha barn med, och insikten om att det aldrig finns några garantier för att ett barn ska födas friskt.
– För mig är det viktigast av allt att det finns kärlek, ömhet, respekt – sådant som man behöver när man växer upp.
Det började med en groda

Tekniken för att flytta en kärna från en cell till en annan utvecklades för att besvara en grundläggande fråga inom biologin: Vad händer när ett befruktat ägg utvecklas till ett embryo?
Det befruktade ägget ger upphov till alla slags celler i hjärnan, huden, musklerna och andra vävnader i kroppen. Under första hälften av 1900-talet ansåg många forskare att celler på väg mot en speciell uppgift gör sig av med arvsmassa som de inte behöver.
De amerikanska biologerna Robert Briggs och Thomas King bestämde sig för att undersöka saken genom ett experiment med leopardgrodor. De ersatte cellkärnan i ett grodägg med kärnan från ett tidigt embryo. Ägget utvecklades till en groda.
Senare kunde britten John Gurdon klona en groda från en fullt specialiserad cell, vilket gav honom ett Nobelpris år 2012. Detta, tillsammans med kloningen av fåret Dolly och andra djur, visar att specialiserade celler faktiskt har kvar all arvsmassa.
Banbrytande biolog fick rätt
Den amerikanska biologen Lynn Margulis fick nobben av femton olika vetenskapliga tidskrifter innan hon år 1967 äntligen kunde publicera sin teori om uppkomsten av det slags celler som kroppen består av. Till skillnad från bakterierna har våra celler en kärna. Runt den finns upp till ett par tusen mitokondrier med eget dna.
Lynn Margulis menade att arrangemanget uppstod genom att något slags urcell släppte in en bakterie för över en miljard år sedan. Det ledde till ett samarbete till gagn för båda parter. Bakterien får skydd, och betalar för uppehället genom att omvandla energirika molekyler till den typ av bränsle som värdcellen behöver.
Med tiden har Lynn Margulis banbrytande idé blivit allmänt accepterad. Numera är det känt att mitokondrier innehåller arvsmassa med släktband till vissa fritt levande bakterier.