Bild: Martin Stenmark
Snart kan vi ha en ny svensk medicin mot alzheimer
En mutation hos en släkt i Norrland gav Lars Lannfelt idén till en ny medicin mot alzheimer. Det var för 20 år sedan. I höst kommer svaret på om hans läkemedel kan bota patienter.
Den här artikelns publicerades först i augusti 2022. Den 6 januari 2023 godkände den amerikanska läkemedelsmyndigheten FDA den nya medicinen mot alzheimer.
Under den senaste halvtimmen har Lars Lannfelt blivit 30 miljoner kronor rikare. Klockan är halv tio på förmiddagen och företaget Bioarctic har nyss skickat ut ett pressmeddelande om att man tagit ytterligare ett steg på vägen mot en ansökan om att få ett läkemedel mot alzheimer godkänt i USA. Aktien tog ett glädjeskutt. Företagets störste ägare tar det med ro.
– Jag gör inte det här för pengarna, säger Lars Lannfelt, seniorprofessor i geriatrik vid Uppsala universitet.
År 2003 grundade han Bioarctic tillsammans med kompisen Pär Gellerfors. Företaget håller till på Kungsholmen i Stockholm. Urtavlor på en vägg i stora konferensrummet på åttonde våningen anger tiden i Tokyo, Stockholm, London och New York.
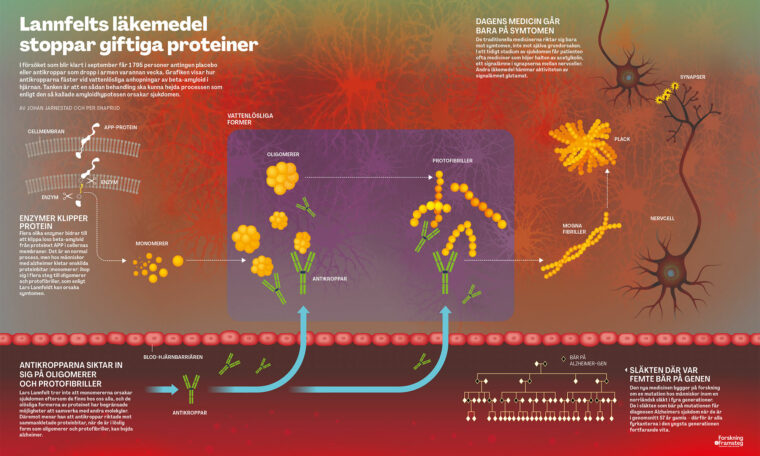
I slutet av september eller början av oktober kommer klockorna att ticka sig fram mot ett avgörande ögonblick inför hoppfulla medarbetare. Då väntas resultat från den mest omfattande typen av läkemedelstest – en så kallad fas 3-studie – med en behandling i form av en antikropp mot alzheimer. Det blir sanningens minut för Bioarctic. Sammanlagt 1 795 försökspersoner runt om i världen ingår i läkemedelsstudien. De får antingen placebo eller antikroppar som dropp i armen varannan vecka. Tanken är att antikropparna ska hejda processen som orsakar sjukdomen.
– De äldre medicinerna riktar sig bara mot symtomen, inte mot själva grundorsaken, säger Lars Lannfelt.
Två slags sjukliga förändringar präglar hjärnan hos en människa med alzheimer. Först kommer placken, anhopningar av proteinet beta-amyloid utanför cellerna. Placken uppträder först i hippocampus, en del av tinningloberna som behövs för att lagra nya minnen. I ett senare skede visar sig även så kallade tangles. Det är trassliga härvor av proteinet tau som bildas inuti nervceller.
Sprider sig till en större del av hjärnan
Placken och tau-härvorna sprider sig med tiden till allt större delar av hjärnan och hindrar signaler från att komma fram. Följden blir att nervceller sakta förtvinar och dör. Forskare har länge drömt om att hejda eller rent av förebygga förloppet.
Förra sommaren såg drömmen ut att bli verklighet. Då godkände den amerikanska läkemedelsmyndigheten FDA för första gången ett läkemedel mot förändringar kopplade till själva sjukdomen. Händelsen ledde till stora rubriker. Det hade gått nästan två decennier sedan en ny alzheimermedicin kom ut på marknaden – och den var enbart symtomlindrande.
Lannfelts läkemedel stoppar giftiga proteiner
Den nya medicinen från det amerikanska företaget Biogen är en antikropp (aducanumab) riktad mot de amyloida placken. Men den blev godkänd på minst sagt omstridda grunder.
Många forskare var skeptiska. Trots att antikropparna rensar bort amyloida plack i hjärnan är det oklart om de verkligen gör någon nytta när det gäller att skydda patienternas förmåga att komma ihåg saker i sin vardag.
En expertkommitté inom FDA avrådde från ett godkännande. I slutänden bestämde sig myndigheten dock för att köra över sina egna experter. För att i någon mån gå kritiken till mötes infördes flera villkor. Biogen måste genomföra fler studier som i första hand ska visa om behandlingen är säker under lång tid, och om den verkligen hjälper patienterna på ett sätt som spelar roll i verkliga livet.
Amerikanska läkemedlet för dyrt
Även priset blev en stridsfråga. Från början kostade behandlingen 462 000 kronor per år. Trots att Biogen gick med på att halvera priset bestämde sig det statliga amerikanska subventionsprogrammet Medicare för att i praktiken utestänga medicinen. Det krossade företagets förhoppningar om en lönsam storsäljare mot en viktig folksjukdom. Den högste chefen fick sparken och Biogen drog tillbaka en ansökan om godkännande i Europa.
Lyckligtvis pågår forskning om andra sätt att hejda de sjukliga förändringarna bakom Alzheimers sjukdom. Bland dem finns antikroppen från svenska Bioarctic, även den baserad på att beta-amyloid spelar huvudrollen i sjukdomsförloppet.
Denna tanke – känd som amyloidhypotesen – formulerades av den brittiske neurogenetikern John Hardy vid University College London i början av nittiotalet. Hans forskargrupp upptäckte att en dominant nedärvd mutation orsakade en ärftlig form av alzheimer hos två brittiska familjer. Vidare studier av liknande familjer, bland annat i Sverige, har gett detaljerade kunskaper om beta-amyloidens biologi.
Bild: Wikimedia commons
Flera olika enzymer i kroppen bidrar till att klippa loss beta-amyloid från ett större protein som är inbäddat i cellernas membraner. Det är en normal process. Den pågår hela tiden i hela kroppen hos alla människor.
Hos bärare av vissa sällsynta mutationer är enzymerna annorlunda. Sådana enzymer klipper loss en ovanligt lång variant av beta-amyloid-proteinet som har en ökad benägenhet att kleta ihop sig. Detta sker i flera steg (se grafik). Enskilda vattenlösliga proteinmolekyler bildar härvor (protofibriller) som fortfarande löser sig i vätskan kring hjärnans celler. Härvorna växer sedan till mogna fibriller. Dessa mogna fibriller löser sig dåligt i den omgivande vätskan. Så småningom klumpar de ihop sig till fasta plack runt omkring i hjärnan.
Samlade prover från norrländsk släkt
Om man utgår från att beta-amyloid orsakar alzheimer så finns flera tänkbara sätt att påverka förloppet med läkemedel. Meningarna går isär om vad som har bäst chanser att fungera. Lars Lannfelts syn på saken bygger på forskning som började år 1998 när han fick ett brev från en distriktsläkare i Umeå. Läkaren berättade om en släkt med många alzheimersjuka. Lars Lannfelt flög norrut och träffade medlemmar ur släkten, samlade blodprover och hörde berättelser om anhöriga som redan i unga år fått svårt att hålla färska händelser i minnet. En stor del av informationen kom från kvinnor, både inom släkten och ingifta.
– Det verkar som om kvinnor håller bättre reda på släktförhållanden än män, säger Lars Lannfelt.
En vetenskaplig rapport publicerad 2001 innehåller ett släktträd i fyra generationer där varje individ symboliseras av en svart eller vit fyrkant. Nästan en femtedel är svarta, vilket betyder att de har en alzheimerdiagnos. I den yngsta generationen är fyrkanterna fortfarande vita eftersom släktens sjukdom i genomsnitt uppträder vid 57 års ålder.
Jakten på mutationen gav resultat. Lars Lannfelt och hans medarbetare kom fram till att den nordsvenska släktens ärftliga form av alzheimer beror på att en enda bokstav i den genetiska koden är utbytt – ett G i stället för ett A i en gen som styr cellernas produktion av beta-amyloid. Bokstavsbytet blev känt som den arktiska mutationen. Sjukdomen drabbar alla bärare.
Den typen av ärftlighet är ovanlig. Alzheimer är den vanligaste av alla demenssjukdomar och i dag har omkring 100 000 människor i Sverige diagnosen. Motsvarande uppskattning för hela världen är över 30 miljoner. I takt med att den genomsnittliga livslängden stiger i nästan alla länder väntas antalet öka till mer än det dubbla i mitten av seklet.
Testningens fyra faser
Innan ett läkemedel kommer ut på marknaden testas det noggrant i olika faser.
Fas 1. Är produkten säker? Det är en viktig fråga i de första mänskliga försöken som brukar innefatta gradvis ökande doser till några tiotals friska personer.
Fas 2. En något större grupp med den aktuella sjukdomen får medicinen. Studien ska visa om behandlingen har
någon effekt och i så fall vilken dos som är bäst.
Fas 3. Ännu fler patienter – några hundra till flera tusen – studeras för att få mer information om effekt och biverkningar jämfört med standardbehandling eller placebo under en längre tidsperiod. Om resultaten är bra kan man ansöka om att få behandlingen godkänd.
Fas 4. När produkten kommit ut på marknaden görs stora studier för att bland annat hitta ovanliga biverkningar.
Källa: Enheten för kliniska studier, Vetenskapsrådet
Den övervägande majoriteten av alla patienter har vad som kallas den sporadiska formen av alzheimer. Den drabbar människor utan ovanligt många fall i släkten. Ett fåtal riskgener är kända, men de påverkar bara sannolikheten att få sjukdomen. Bärare kan mycket väl leva ett långt liv utan minsta tecken på demens.
Det gäller alltså inte för människor med den arktiska mutationen. Noggranna analyser avslöjade höga halter av protofibriller, vattenlösliga härvor av beta-amyloid. Lars Lannfelts slutsats är att protofibriller är giftiga.
– Själva proteinet, beta-amyloid, kan knappast vara skadligt. Det har vi ju alla överallt i kroppen, säger han.
Inte heller fullt utvecklade fibriller borde vara särskilt giftiga eftersom de är olösliga och därmed inte kan samverka så mycket med andra molekyler, menar Lars Lannfelt. Därmed riktar han sina misstankar mot protofibrillerna. Slutklämmen i hans vetenskapliga artikel om den arktiska mutationen från 2001 är att det borde gå att stoppa alzheimer med ett läkemedel riktat direkt mot protofibrillerna. Exakt det är vad företaget Bioarctic strävar efter.
Det första steget var att utveckla en specifik typ av identiska antikroppar mot protofibriller hos möss. Dessa så kallade monoklonala antikroppar fungerade så bra att forskarna bestämde sig för att ta fram motsvarande antikroppar mot protofibriller för människor.
Forskningen kostar multum
I den här typen av forskning är insatserna höga. En tumregel i branschen är att det kostar ungefär en miljard dollar att utveckla ett nytt läkemedel mot alzheimer. Genom åren har många förhoppningar blivit grusade.

Bild: Martin Stenmark
Ett plågsamt bakslag inträffade i slutet av 00-talet när det visade sig att en antikropp mot beta-amyloid som utvecklats av ett amerikanskt och ett irländskt läkemedelsbolag kan få hjärnan att svullna. Vätska samlas i hjärnvävnaden. Bland symtomen finns huvudvärk, illamående, skakningar och i vissa fall synstörningar. Efter en avbruten behandling brukar problemen försvinna.
Trots den typen av motgångar har ett tjugotal kliniska studier av experimentella behandlingar riktade mot beta-amyloid hittills tagit sig ända till fas 3. En enda av dem har lett till en godkänd behandling. Och den antikropp som blev godkänd i USA förra sommaren är som sagt omstridd.
Bristen på övertygande framgångar har lett till kritik mot hela amyloidhypotesen. Vissa forskare menar att beta-amyloid är ett blindspår och väljer att i stället fokusera på proteinet tau. Skämtsamt kallas de för tauister. Och de som håller fast vid att beta-amyloid är viktigast har fått benämningen baptister. I striden mellan tauister och baptister är Lars Lannfelt helt klart på baptisternas sida.
– Jag tycker att det är lika väl belagt att beta-amyloid startar Alzheimers sjukdom som att hiv orsakar aids, säger han.
”Glömskans sjukdom”
- Den tyske psykiatern Alois Alzheimer beskrev år 1906 vad han kallade ”glömskans sjukdom”, som senare fick hans namn.
- Alzheimer är den vanligaste demenssjukdomen och står för 60 till 70 procent av alla fall.
- Omkring 100 000 människor i Sverige har diagnosen. Motsvarande uppskattning för hela världen är över 30 miljoner.
- Förutom minnet påverkar sjukdomen bland annat förmågan att uttrycka sig, lokalsinnet, omdömet och koncentrationen.
- Hjärnan hos en människa med alzheimer har en rubbad omsättning av proteinerna beta-amyloid och tau.
- Mätningar av beta-amyloid och tau i ryggmärgsvätska gör att man i dag kan diagnosticera sjukdomen tidigt.
För fyra år sedan kom resultat som ytterligare stärkte honom i tron på beta-amyloid. En fas 2-studie i samarbete med det japanska läkemedelsföretaget Eisai på sammanlagt 856 personer med tidig alzheimer gav lovande resultat. Antikroppen som bygger på den arktiska mutationen sänkte mängden beta-amyloid i hjärnan och tycktes också bromsa sjukdomen. Dessutom var biverkningar sällsynta. När Bioarctic berättade om resultaten i ett pressmeddelande den 6 juli 2018 rusade företagets aktie med över 300 procent på två dagar. Lars Lannfelt blev mångmiljardär.
– Det är ju trevligt, säger han.
Men det har inte lett till några omvälvande förändringar. Han la en slant på en ny sommarstuga i Stockholms skärgård, men bor kvar med sin hustru i en helt vanlig lägenhet i Stockholm och kör en Volvo från 2009.
Lars Lannfelt har nyligen fyllt 73 men har inga planer på att gå i pension. Forskningen om läkemedel mot alzheimer ger spänning i vardagen. Och snart kommer en dag med extra mycket spänning. Lars Lannfelt är optimistisk. Han hoppas att resultaten från den stora fas 3-studien i september kommer att bekräfta att hans antikropp fungerar. Men nu när det avgörande ögonblicket närmar sig har han trots allt blivit lite pirrig:
– Jag har över 20 års engagemang i det här, så det är klart att det börjar kännas.
Läs uppföljningen: Framgång för svensk antikropp mot Alzheimers sjukdom

Prenumerera på Forskning & Framsteg!
10 tidningsnummer om året och dagliga nyheter på fof.se med kunskap baserad på vetenskap.