Drew Weissman och Katalin Karikó har varit ett vetenskapligt radarpar under ett kvarts sekel.
Bild: Penn medicine
De har räddat miljontals människor
Vaccin mot covid-19 baserat på m-rna räddade liv, öppnade samhället och fick oss att våga kramas igen. 2023 års medicinpris går till två forskare som gjorde det möjligt.
Katalin Karikó och Drew Weissman träffades för första gången vid en kopieringsmaskin i en korridor på University of Pennsylvania i USA år 1998. De förenades direkt av ett gemensamt intresse: m-rna-molekyler. I övrigt är de ganska olika.
Drew Weissman beskrivs som reserverad. Han växte upp i en välmående förort till Boston på den amerikanska östkusten med fritidsintressen som segling och tennis. Hans mamma var tandhygienist och pappan ägde ett företag som tillverkade speglar till satelliter. Själv utbildade han sig till läkare vid högt rankade Boston university. Kort sagt, en man med goda förutsättningar att passa in i den akademiska världen med alla dess outtalade normer och maktrelationer.
Katalin Karikós bakgrund är radikalt annorlunda. Hon och Drew Weissman får var sin hälft av årets medicinpris för genombrott som ledde till effektiva m-rna-vacciner mot covid-19. Men det är hennes berättelse som fängslar, och som säger mest om vad det kan kosta att satsa helhjärtat på en idé bortom rådande konventioner.
Misstro mot m-rna som läkemedel
Idén är att använda budbärar-rna, även kallat m-rna (messenger rna) som läkemedel. Molekylerna bildas naturligt inuti kroppens celler som ett slags arbetsritningar med genetisk information från kärnans dna. Cellerna använder sedan arbetsritningarna när de tillverkar olika proteiner.
Redan i mitten av 1980-talet utvecklade forskare i USA metoder för att på rent kemisk väg snabbt och enkelt tillverka konstgjort m-rna i provrör. Haken är att molekylerna är instabila. De bryts ner på nolltid. Därför var det en utbredd uppfattning att m-rna knappast skulle fungera vare sig som vaccin eller någon annan typ av läkemedel.
Bild: Getty images
Katalin Karikó hade tidigt en avvikande mening. Hon växte upp i Kisújszállás, en by mitt i Ungern med cirka 10 000 invånare. Mamman var bokhållare och pappan slaktare. De bodde i ett hus med två rum utan tv och rinnande vatten.
Det visade sig att Katalin hade läshuvud. Hon utbildade sig till biokemist vid University of Szeged, där hon träffade sin man och skrev en doktorsavhandling om rna medan hon var gravid.
År 1985 fick hon en forskartjänst i USA och reste dit tillsammans med sin make och deras då 2,5-åriga dotter. På den tiden fick medborgare ta med sig högst 100 dollar när de lämnade Ungern, en kommunistisk stat bakom järnridån. Ytterligare 1 200 dollar från en bilförsäljning hade hon gömt inuti dotterns teddybjörn.
Efter ett par korta anställningar fick hon så småningom ett jobb på University of Pennsylvania, ett jobb med ordet ”professor” i tjänstebeskrivningen men utan vare sig anslag eller möjlighet till fast anställning som ordinarie professor. Pengar till sin forskning måste hon söka själv eller skaffa via samarbeten med mer välbemedlade kollegor.
Det gick trögt. Och det underlättade knappast att hon var kvinna, bröt på ungerska, hade examen från ett okänt universitet och var biokemist på en institution för medicinsk forskning, där alla vet att en läkarutbildning står högst i rang.
Medicinpriset 2023: Katalin Karikó och Drew Weissman

- Biokemisten Katalin Karikó föddes 1955 i Szolnok i Ungern.
- Hon doktorerade vid Szegeds universitet 1982 och genomförde postdoktoral forskning vid den ungerska vetenskaps-akademien i Szeged fram till 1985. Hon genomförde ytterligare perioder av postdoktoral forskning vid Temple University i Philadelphia och senare vid University of Health Sciences, Bethesda.
- 1989 blev hon utnämnd till Assistant Professor vid University of Pennsylvania, vilket hon förblev fram till 2013 då hon utnämndes till vice president och senare senior vice president vid BioNTech RNA Pharmaceuticals.
- Hon är sedan 2021 professor vid Szegeds universitet och är adjungerad professor vid Perelman School of Medicine vid University of Pennsylvania.
- Var länge känd för att vara mamma till Susan Francia, tvåfaldig olympisk guldmedaljör i rodd. Numera är dottern känd för att ha en Nobelprisbelönad mamma.
Källa: Nobelförsamlingen
- Drew Weissman föddes 1959 i Lexington, Massachusetts, USA.
- Han tog sin MD, PhD-examen vid Boston University 1987 och genomgick klinisk utbildning vid Beth Israel Deaconess Medical Center vid Harvard Medical School. Detta följdes av postdoktoral forskning vid National Institutes of Health. 1997 inledde Weissman forskning vid Perelman School of Medicine vid University of Pennsylvania och han är där Roberts Family Professor i vaccin-forskning och föreståndare för the Penn Institute for RNA Innovations.
- Känd för att vara tystlåten. Familjen skämtar om att han har en daglig kvot av ord. Vid ett tillfälle ska han – utan illvilja – ha avbrutit sin fru med ”vi har redan pratat i dag”.
Karikó och Weissman möttes av en slump
En dag år 1998 mötte hon av en slump läkaren och immunologen Drew Weissman i kön till en kopieringsmaskin som deras respektive laboratorier delade på. Som vanligt pratade hon om m-rna. Drew Weissman var för sin del mest intresserad av ett slags celler som sedda genom ett mikroskop ser ut som rufsiga bollar, så kallade dendritiska celler som ingår i immunsystemet. På sin yta presenterar de bitar av ett virus eller något annat kroppsfrämmande, så att andra delar av immunsystemet kan känna igen inkräktarna och gå till en riktad attack.
En av Drew Weissmans drömmar var att utveckla någon typ av vaccin som skulle kunna aktivera immunförsvaret mot hiv. De båda forskarna insåg att deras kunskaper om immunsystemets celler respektive rna kompletterade varandra. Det bestämde sig snabbt för att tillsammans utforska möjligheterna att använda m-rna som vaccin.
Ett vaccin är ett ämne som retar immunsystemet så att det lär sig bekämpa infektioner eller annat skadligt i kroppen. Ordet vaccin kommer från latinets ord för ko, vacca, på grund av ett experiment som den engelske läkaren Edward Jenner utförde år 1796. Han tog fasta på att mjölkerskor som haft den lindriga sjukdomen kokoppor inte fick smittkoppor. I ett experiment som ingen etisk nämnd i dag skulle godkänna smittade han en åttaårig pojke med kokoppor. Pojken blev lite krasslig i några dagar. Två månader senare smittade Jenner honom med smittkoppor, som inte påverkade honom alls.
Sedan dess har forskare tagit fram massor av vacciner baserade på försvagade eller avdödade virus mot farliga sjukdomar som polio, mässling och gula febern. Under de senaste decennierna har nya molekylärbiologiska metoder även gjort det möjligt att tillverka vacciner som bara innehåller vissa delar av ett virus, oftast ytproteiner. Det gäller till exempel vaccinerna mot hepatit B-viruset och humant papillomvirus.
En ytterligare typ av vaccin består av ett ofarligt bärarvirus – en så kallad vektor – som på genteknisk väg blivit extrautrustat med arvsmassa från ett smittämne. Vektorvacciner används bland annat mot ebola.
Enkelt i teorin – svårt i praktiken
En nackdel med alla dessa vacciner är att de kräver cellodlingar i industriell skala. Odlingarna är tekniskt komplicerade, tar lång tid och kan dessutom drabbas av infektioner och andra problem. Molekyler av m-rna, däremot, kan tillverkas snabbt och billigt i provrör.
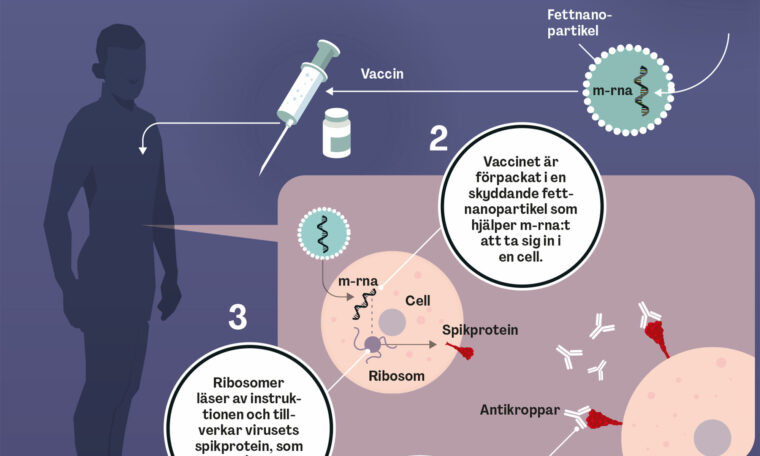
I teorin är det enkelt att använda m-rna som vaccin: Injicera de biologiska arbetsritningarna så att celler i kroppen kan använda dem till att producera ett protein (i fallet covid: det så kallade spikproteinet på virusets yta). Proteinet, i sin tur, retar immunsystemet så att det bygger upp motståndskraft mot inkräktaren. Målet är alltså att få kroppens egna celler att under en begränsad tid fungera som vaccinfabriker. En elegant idé. Att omsätta den i verklighet skulle visa sig desto svårare.
Katalin Karikó tillverkade konstgjort m-rna som Drew Weissman testade på sina dendritiska celler. Resultatet var beklämmande. Cellerna reagerade som om de hade stött på något totalt främmande. De utsöndrade stora mängder inflammatoriska ämnen. Slutsatsen blev att konstgjort m-rna knappast skulle fungera som läkemedel.
Men forskarna gav sig inte. De upptäckte att m-rna producerat inuti däggdjursceller inte gav upphov till samma reaktioner. Hur kunde det komma sig?
Varje rna-molekyl innehåller information nedtecknad med fyra kemiska byggstenar, ett slags bokstäver i den genetiska kodens alfabet: A, U, G och C. När kroppens celler tillverkar rna uppstår små kemiska förändringar på några av byggstenarna. Det sker inte vid tillverkning i provrör. Därför bestämde sig Katalin Karikó och Drew Weissman för att göra liknande förändringar på konstgjort rna. Det blev succé.
När de utsatte dendritiska celler för m-rna med kemiska förändringar på bokstaven U uteblev den inflammatoriska reaktionen nästan helt. De skickade en rapport om genombrottet till den världsledande vetenskapliga tidskriften Nature. Inom ett dygn fick de besked om att framsteget var för litet för att förtjäna läsarnas uppmärksamhet. Efter flera nej från fina tidskrifter lyckades de till slut få artikeln publicerad i den nischade tidskriften Immunity den 23 augusti 2005. Den väckte minimalt intresse.
I uppföljande försök visade forskarna att deras kemiskt förändrade m-rna-molekyler har ytterligare fördelar. Jämfört med oförändrade varianter är de mer stabila och – inte minst – de ger upphov till mer protein, vilket behövs för att få ett bra immunsvar mot ett smittämne.
Upprepade avslag fick Karikó att lämna
Men berömmelsen uteblev. Katalin Karikó fick avslag efter avslag på sina ansökningar om pengar till sin forskning. År 2013 bestämde hon sig för att lämna University of Pennsylvania för att i stället ta ett jobb på då okända Biontech RNA Pharmaceuticals i Tyskland, från början med sikte på att utveckla behandlingar mot cancer. När covid-19 slog till satsade företaget i stället allt på att ta fram ett vaccin baserat på den forskning som belönas med årets Nobelpris. Det gjorde även företaget Moderna i USA.
Så fungerar vaccin med mRNA
Historien visar att det brukar ta minst fem till tio år att utveckla ett helt nytt vaccin. När pandemin började hade Katalin Karikós och Drew Weissmans forskning redan lett till att kliniska prövningar mot flera andra infektioner och sjukdomar kommit i gång.
Forskare som kände till utvecklingen insåg att det fanns gott hopp om att m-rna skulle leda till ett fungerande vaccin snabbare än traditionella metoder. En vanlig uppskattning var att det kunde bli klart inom ett par år.
– Men det visade sig gå dubbelt så fort, säger Gunilla Karlsson Hedestam, professor i vaccinimmunologi vid Karolinska institutet.
Hon tog själv sprutan så fort den blev tillgänglig och betraktar vaccinet som säkert. Det finns såklart inga garantier mot att någon hittills okänd biverkan dyker upp om tio år eftersom vaccinet är så nytt. Så är det med alla nya vacciner och läkemedel.
– Med de data som finns, med så många människor och den tid som ändå har gått, ser vi inget som tyder på bakslag, säger Gunilla Karlsson Hedestam.
Hittills har människor i hela världen fått mer än 13 miljarder sprutor med olika slags vaccin mot covid-19. Det har räddat miljontals liv och förkortade vår väntan på att kunna börja umgås och leva som vanligt.
Stort genombrott för m-rna
Pandemin blev det stora genombrottet för m-rna-vacciner. På mindre än ett år byggdes fabriker för produktion i global skala, samtidigt som regulatoriska myndigheter utvecklade rutiner för att snabbt utvärdera metoden.
Marknaden för m-rna-läkemedel växer snabbt. I fjol var den värd drygt 550 miljarder kronor, enligt en rapport från företaget Roots analysis. Dussintals läkemedelsbolag driver mer än 195 projekt som syftar till att utveckla behandlingar baserade på m-rna. Det stora flertalet gäller vacciner mot mängder av smittor som RS-virus, hiv och malaria.
Men tekniken är bredare än så. Ett snabbt växande område är cancerbehandlingar av skilda slag. Dessutom pågår försök att använda m-rna mot genetiska sjukdomar, bland annat sicklecellsjukdom. Varje år föds uppåt 300 000 barn med sjukdomen, framför allt i Afrika och delar av Asien. Den påverkar kroppens röda blodkroppar, vilket bland annat kan leda till svåra smärtor och stroke. Drew Weissman har utvecklat m-rna-teknik som med en enkel spruta lindrar sjukdomen genom att påverka stamceller i benmärgen. Behandlingen har gett lovande resultat i möss och ska enligt planerna snart testas på apor.
Utvecklingen av nya läkemedel baserade på årets medicinpris har bara börjat.

Kunskap baserad på vetenskap
Prenumerera på Forskning & Framsteg!
Inlogg på fof.se • Tidning • Arkiv med tidigare nummer