Två sätt att trimma ett mikroskop
NOBELPRIS I KEMI 2014: Eric Betzig, Stefan W. Hell och William E. Moerner har lyckats lura sig förbi gränsen för hur små detaljer som ansågs vara möjliga att betrakta med ljusmikroskop. Tack vare deras genombrott kan forskare nu studera livet på molekylnivå i realtid, och se strukturen i enskilda nervcellers synapser.
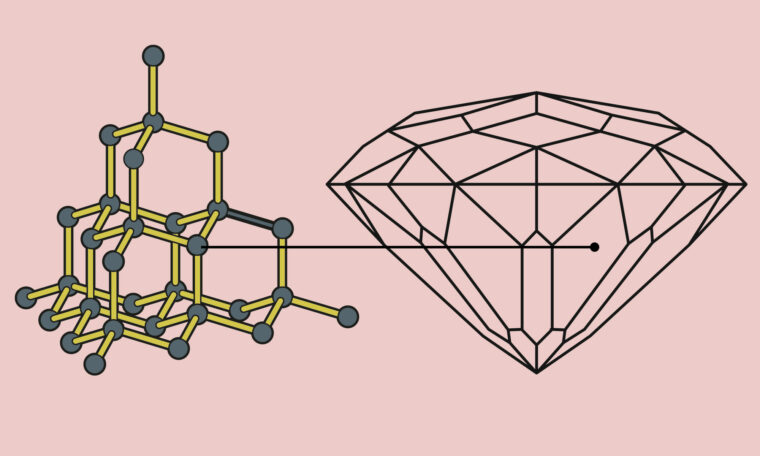
Generationer av mikroskopforskare har fått lära sig att fysikens lagar sätter en orubblig gräns för ljusmikroskopins upplösning. Föremål mindre än cirka 0,2 mikrometer skulle aldrig gå att se, konstaterade den tyske fysikern Ernst Abbe 1873. En orsak var ljusets egen våglängd, som begränsar den möjliga upplösningen – ungefär som att tjockleken på en pennspets sätter en gräns för hur tunna streck som kan ritas. Denna begränsning kom att kallas för Abbes gräns.
Därför är det förståeligt att årets Nobelpristagare i kemi har haft svårt att få gehör för sina idéer om att driva ljusmikroskopin förbi Abbes gräns, ända ner till nanonivå. Stefan Hell har berättat hur han kämpade för att finna akademiskt fotfäste och var nära att ge upp. Och Eric Betzig lämnade faktiskt forskningsvärlden helt och hållet i mitten av 1990-talet – men kom tillbaka flera år senare.
I dag är de i stället firade stjärnor. Fysikens lagar kan som bekant inte brytas, men precis som annan lagstiftning kan de ibland kringgås. Tack vare Eric Betzig, Stefan Hell och W.E. Moerner har forskningen i dag inte bara ett utan flera eleganta sätt att komma förbi Abbes gräns. Metoderna kallas med ett gemensamt namn för superupplösningsmikroskopi, eller nanoskopi, och har fått enorm betydelse för den biologiska forskningen.
Det är två olika koncept för nanoskopi som belönas, men de har vissa gemensamma nämnare. Båda utnyttjar fluorescerande markörer som kan tändas och släckas med laserljus. Tricket för att spränga Abbes gräns är att släcka nästan alla fluorescenta markörer i provet och bara registrera några i taget. Detta åstadkommer de två teknikerna på var sitt sätt.
Stefan Hell, född i Rumänien och verksam i Tyskland, har utvecklat den så kallade STED-mikroskopin. Hans svar på utmaningen att teckna tunna linjer med tjock penna är att ha två pennor, och att använda den ena som radergummi. I verkligheten består pennorna av laserljus med olika våglängd. Den ena lasern aktiverar en mängd fluorescerande markörer, medan den andra omedelbart släcker de flesta av dem. Kvar blir en minimal fläck av tända markörer som mikroskopet registrerar. Genom att låta de två laserstrålarna svepa över provet läses hela mikroskopbilden in, punkt för punkt. Stefan Hell fick idén 1993, under sin tid som ung forskare vid Åbo universitet. Sju år senare hade han byggt prototypen för ett STED-mikroskop och kunde visa att idén faktiskt fungerar i verkligheten.
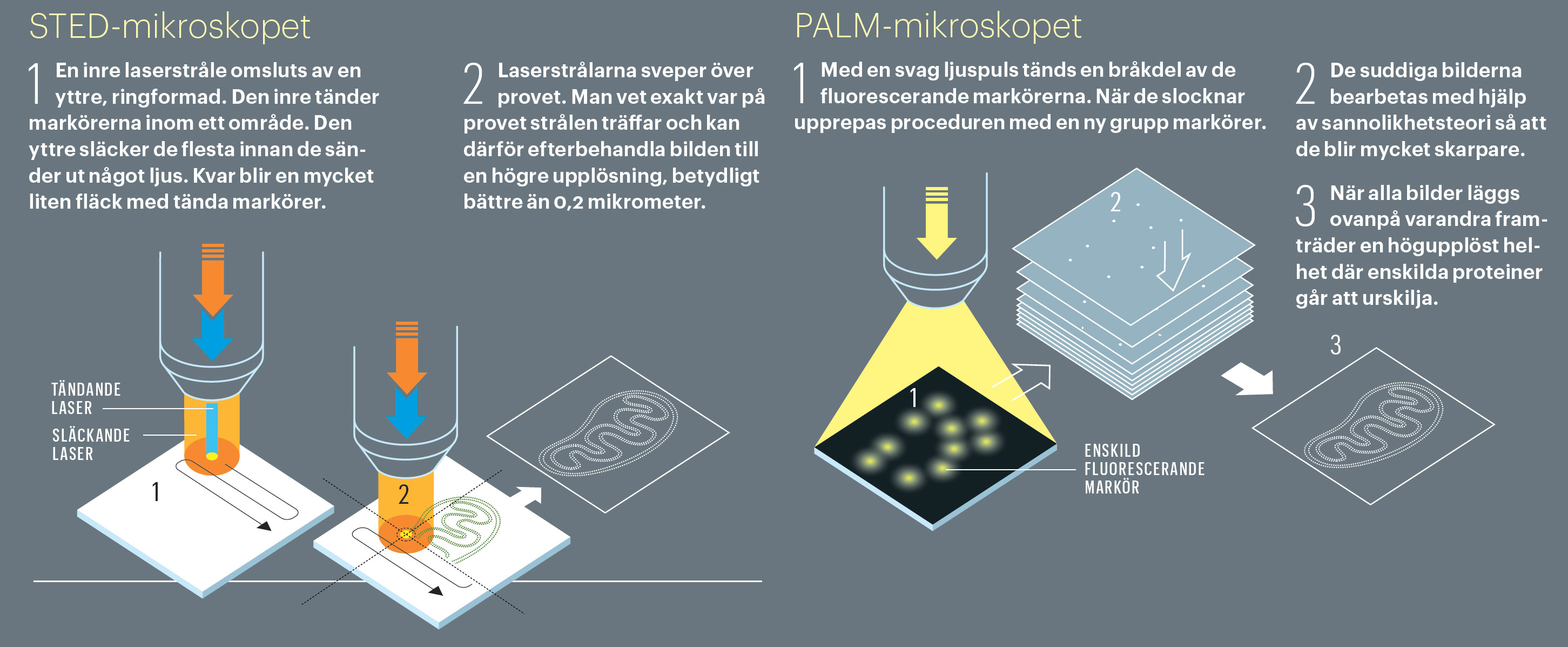
De strukturer i cellen som ska undersökas färgas med fluorescerande markörer (proteiner eller antikroppar). Då kan forskarna se dem i mikroskop. Markörernas ljus slås på och av med laserpulser.
Bild: Johan Jarnestad
Amerikanerna Eric Betzig och W.E. Moerner står för de avgörande upptäckterna bakom den andra principen, som kallas PALM. I denna teknik belyses preparatet upprepade gånger med en laserpuls som är så svag att bara ett fåtal av ljusmarkörerna aktiveras. Mikroskopet registrerar platsen för var och en av dessa. Efter tusentals eller tiotusentals upprepningar sammanställs informationen från alla exponeringar till en färdig bild.
Här kommer vi till kärnan i hur det är möjligt att kringgå Abbes gräns: även en suddig fläck kan, under vissa omständigheter, ge skarp information. I grunden är det inte konstigare än att en mycket närsynt person kan lokalisera en ensam lampa i ett mörkt rum, trots att den bara syns som en suddig fläck. Den ensamma ljuskällan finns exakt mitt i fläcken.
– Det som var slående när man först läste om de här teknikerna var hur enkla de är. Och samtidigt: jäklar vad bra! Stora upptäckter är ofta enkla. STED och PALM är exempel på det, säger professor Hjalmar Brismar.
Han ansvarar för enheten Advanced light microscopy, på SciLifeLab i Solna. Hit kommer forskare från hela Sverige för att använda mikroskop med superupplösning. Här finns STED och PALM, samt en rad varianter med nya akronymer.
Nanoskopin har inneburit en revolution för den biologiska forskningen. Nu går det att titta in i en levande cell och studera dess strukturer i detalj. Eftersom mikroskopen är snabba går det att ta rörliga bilder och filma händelser på molekylnivå i den levande cellen.
– Min forskning handlar om processer i nervcellernas synapser, säger Hjalmar Brismar. Tidigare kunde jag se att ett visst protein fanns där, nu kan jag se precis var det sitter. Det är avgörande när man försöker förstå exakt hur något fungerar, eller vad som blivit fel vid olika sjukdomar.
Det första superupplösningsmikroskopet på SciLifeLab köptes 2010. Det har nu skänkts bort och ersatts av nyare system. Livslängden är starkt begränsad, inte på grund av slitage, utan på grund av den snabba tekniska utvecklingen. Bara några dagar innan den här texten skrivs packades det senaste mikroskopet upp, labbets första med 3D-funktion.
Tre smarta sätt att utnyttja superupplösning
1 Titta på levande hjärnceller
Stefan Hells forskargrupp vid Max Planck-institutet för biofysikalisk kemi i Göttingen, Tyskland, har använt STED för att ta rörliga bilder i 3D av aktiviteten inuti en hjärncell hos en levande råtta. För att hjärnan ska vara synlig för mikroskopet, men samtidigt skyddad och fungera normalt, opereras ett litet ”fönster” av glas in i försöksdjurets skallben.
2 Tjuvlyssna på bakterier
Bakterier i en population kan samtala med varandra och koordinera sig så att de uppträder som en flercellig organism. Elena Vikström vid Linköpings universitet forskar om denna kommunikation, som kallas quorum sensing. Hon använder nanoskopi för att förstå hur celler i människokroppen avlyssnar bakteriernas quorum sensing. Informationen från avlyssningen påverkar bland annat hur immunförsvaret reagerar.
3 Utveckla läkemedel mot parkinson
Professor Angela Cenci Nilsson vid Lunds universitet använder ljusmikroskop med superupplösning för att ta reda på exakt var i nervcellen hjärnans receptorer för signalsubstanser som dopamin och glutamat sitter. Den kunskapen är grundläggande för hennes arbete med att hitta nya behandlingar mot parkinson och liknande sjukdomar.
Nobelpriset i kemi 2014

Eric Betzig, Stefan W. Hell & William E. Moerner.
Motivering: För utveckling av superupplöst fluorescens-mikroskopi.