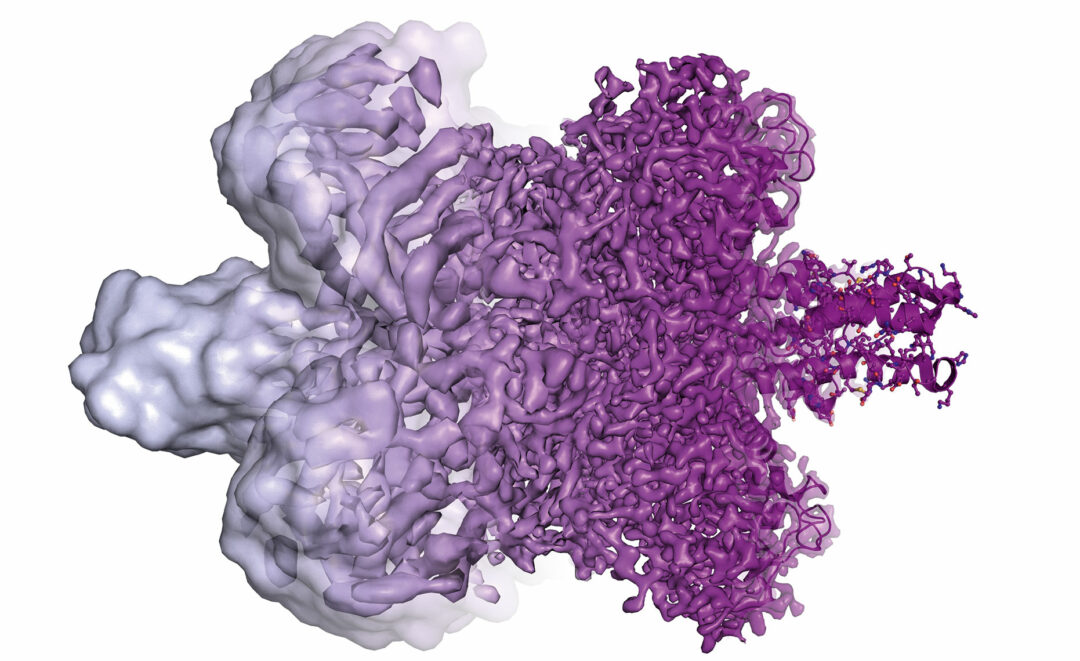
Från blobbor … till enskilda atomer Konsten att tyda bilder från kryo-elektronmikroskop kallades länge ”blobbologi”. Skeptiker tyckte sig bara se oformliga blobbor. Bilderna har gradvis blivit skarpare, i synnerhet efter ett tekniskt genombrott år 2013. Nu är upplösningen 1,8 Å (tiomiljondels millimeter).
Bild: Martin Högbom, © Kungl. Vetenskapsakademien
Ett kikhål in i livets maskineri
Pristagarna har gjort det möjligt att se hur enskilda molekyler arbetar inuti våra celler. Tekniken har utlöst en vetenskaplig ketchupeffekt inom framför allt den medicinska forskningen.
Maskinen är fyra meter hög och kostar ungefär sextio miljoner kronor. Den får ström via en kabel på baksidan, tjock som en arm. Ett stålrör från taket levererar flytande kväve som håller mikroskopets vitala delar på en temperatur lägre än minus 190 grader Celsius.
– Det är revolutionerande teknik, säger Gunnar von Heijne, professor i biokemi vid Stockholms universitet och föreståndare för Sveriges nationella satsning på så kallad kryo-elektronmikroskopi.
Vi befinner oss i en källare under Science for life laboratory, ett nationellt centrum för biovetenskaper, granne med Karolinska institutet i Solna. Mikroskopet kan ta skarpa bilder av en molekyl som, jämfört med en människa, är lika liten som människan är i jämförelse med månen. Årets Nobelpristagare i kemi, Richard Henderson, Jacques Dubochet och Joachim Frank, har lagt den vetenskapliga grunden för en teknik som till och med kan avslöja hur invecklade molekyler ändrar form när de utför olika slags arbete.

Det vitrifierade provet placeras i kryo-elektronmikroskopet. Maskinen tar bilder som en dator sedan omvandlar till en 3D-struktur.
Livets kemi utspelar sig i vattenlösning. För att studeras måste provet frysas, men isen stör mikroskopets elektronstrålar. Lösningen är att omvandla vattnet till glas genom en process som kallas för vitrifiering.
Bild: Johan Jarnestad
I mitten av förra seklet blev det möjligt att studera invecklade molekyler med så kallad röntgenkristallografi, vilket bland annat ledde till upptäckten att dna-molekyler är spiralformade. Men metoden fungerar bara på den bråkdel av allt biologiskt material som kan bilda prydliga kristaller.
Som doktorand vid Cambridge university i Storbritannien ville Richard Henderson studera proteiner inbäddade i membran som omger celler. Sådana proteiner är viktiga bland annat för att de är måltavlor för många läkemedel. Tyvärr brukar försöken att omvandla dem till kristaller sluta med kletig gegga. Efter flera misslyckade försök bestämde sig Richard Henderson för att i stället testa med elektronmikroskopi, som ersätter vanligt ljus med elektroner. Upplösningen är god, men elektronmikroskopets vakuum torkar ut och förstör biologiska prover. Dessutom är risken stor för att proverna blir stekta av den starka elektronstrålningen.
Trots det lyckades Richard Henderson efter många års slit ta skarpa bilder på bakterierodopsin, ett protein som vissa bakterier använder för att utvinna energi ur solljus. Han lät proteinerna vara kvar i membranet och skyddade dem från uttorkning med en sockerlösning. Tack vare att bakterierodopsin sitter så tätt och regelbundet ordnade i sitt membran kunde han använda en svag, skonsam stråldos.
Det var en framgång. Men skeptikerna tvivlade på att hans metod skulle fungera på andra biologiska molekyler, till exempel sådana som svävar runt inne i celler i en miljö som mest består av vatten. En möjlighet var att frysa provet. Haken är dock att iskristaller stör mikroskopets elektronstrålar så att bilderna blir suddiga.
Jacques Dubochet hittade en enkel lösning. På en bänk i källarlaboratoriet i Stockholm står en apparat byggd på hans idéer. Den förbereder biologiska prover inför prövningarna i ett elektronmikroskop, och forskaren Alexander Mühleip visar hur den fungerar. Han placerar några mikroliter av en vattenlösning med ett protein som ska analyseras på en hållare, och trycker på en knapp. Maskinen surrar och brummar. Plötsligt hörs ett plopp. Hållaren doppar blixtsnabbt ner provet i en pytteliten skål med flytande etan.
Nobelpris 2017 kemi
”… för utveckling av kryo-elektronmikroskopi för högupplösande strukturbestämning av biomolekyler i lösning.”



När temperaturen faller med ungefär en miljon grader per sekund bildas ingen is. I stället förvandlas vattnet till något som liknar glas, vilket kallas vitrifierat vatten. Sådant vatten saknar störande iskristaller, och skyddar biomolekylerna mot både torka och hetta.
Jacques Dubochets radikala köldknäpp var ett genombrott. Det ledde till att kryo-elektronmikroskop i dag kan avbilda virus, celldelar och massor av andra vattenlösliga biologiska komponenter.
Årets tredje kemipristagare, Joachim Frank, har utvecklat metoder för att kombinera en stor mängd tvådimensionella bilder till modeller i tre dimensioner. År 1991 lyckades han göra en sådan modell av en ribosom, en molekylär maskin som cellerna använder för sin livsviktiga tillverkning av proteiner.
Det var en stor bedrift, men modellen visade bara grova konturer. Andra forskare tyckte att modellerna var oformliga blobbor och kallade metoden något nedsättande för ”blobbologi”.
Så sent som år 2013 kom en ny typ av detektorer för elektronstrålning som gjorde att kryo-elektronmikroskop för första gången kunde avslöja de enskilda atomernas lägen hos proteiner i en lösning.
– Sedan dess har utvecklingen exploderat, säger Gunnar von Heijne.
Trots det avskräckande priset på maskinen finns det numera över hundra kryo-elektronmikroskop på olika håll i världen. Cirka hälften har levererats till laboratorier i Kina. I Sverige finns tekniken både i Stockholm och Umeå.
I Stockholm handlar en stor del av forskningen om att kartlägga ribosomer från olika organismer, bland annat bakterier och parasiter. Många av dagens antibiotika slår mot ribosomer, som skiljer sig mellan olika arter.
– En tanke är att det ska leda till nya läkemedel, säger Gunnar von Heijne.
Ribosomen är livsviktig hos alla organismer. Ett ämne som förstör ribosomer hos en farlig bakterie eller parasit, utan att skada de mänskliga, kan bli ett effektivt läkemedel.
Tidigare i år upptäckte forskare i Storbritannien och Australien att den drygt trettio år gamla malariamedicinen lariam fungerar genom att angripa parasitens ribosomer. Deras slutsats bygger på bilder tagna med ett kryo-elektronmikroskop. I sin rapport skriver de att avbildningstekniken just nu är den mest lovande metoden för att utveckla nya och effektivare varianter av malariamedicin.

Kunskap baserad på vetenskap
Prenumerera på Forskning & Framsteg!
Inlogg på fof.se • Tidning • Arkiv med tidigare nummer