Att vistas på hög höjd där syrehalten är lägre än vid havsytan triggar cellernas försvar mot syrebrist. En effekt är att hormonet EPO tillverkas, som i sin tur gör att det bildas fler röda blodkroppar.
Image: Getty images
Så hanterar kroppens celler syrebrist
I år belönas upptäckten av hur celler känner av och anpassar sig till syrebrist. Att finjustera en del i detta molekylära maskineri har hittills gett bättre läkemedel mot blodbrist.
Efter en blodpropp går det efter några månader att se att syrebristen i det drabbade området gett upphov till nya blodkärl. Att nybilda kärl är ett långsamt sätt för kroppen att hantera syrebrist, eller hypoxi som det heter på läkarspråk. Betydligt snabbare är att slå på en gen som bildar ett hormon kallat erytropoetin, EPO, som signalerar till benmärgen att kroppen behöver fler röda blodkroppar. Systemet slår exempelvis på vid vistelse på hög höjd där syrehalten är lägre än vid havsytan. Detta utnyttjar idrottsmän vid ”höghöjdsträning”, ett sätt för att få bättre syreupptagningsförmåga.
Första läkemedlet godkänt
Systemet för att känna av och agera på syrebrist är livsviktigt och har betydelse vid exempelvis fosterutveckling, bildandet av blodkärl och finjustering av immunsystemet. Dess komponenter kan också fungera som mål för läkemedel. Vid exempelvis njursvikt bildas för lite eget EPO. Det ger blodbrist som behandlas med syntetiskt framställt hormon. I år godkändes ett nytt läkemedel som gör att EPO bildas. Det är det första som baseras på de upptäckter som årets mottagare av Nobelpriset i fysiologi eller medicin har gjort.
Även inom cancerområdet är syrereglering viktigt. Tumörceller kan kapa det syrereglerande systemet och med hjälp av det tillverka nya blodkärl åt sig själva för att kunna växa snabbt. Idén här är att skapa läkemedel som tvärtom minskar tillgången till syre och det pågår studier för att testa nya läkemedelskandidater.
En av årets pristagare, sir Peter Ratcliffe (2014 adlades han för sina insatser inom klinisk forskning), blev förvånad när telefonen ringde måndagen den 7 oktober.
– Min första tanke var att få klarhet i om det var ett skämt eller inte. Sedan hade vi ont om tid att förbereda oss, eftersom vi hade blandat ihop tidszonerna och fått för oss att tillkännagivandena var först två timmar senare, säger han.
”Vänner, kolleger och konkurrenter”
På frågan om sin relation till de andra pristagarna säger han att han ser dem som vänner, kolleger och som konkurrenter – ”men i olika stunder mer eller mindre av vardera”. Han har sedan han gjorde de nu belönade upptäckterna fortsatt att studera andra system för syrereglering som verkar på olika tidsskalor – från sekunder till månader – bland annat inom njurcancer.
– Komponenter inom dessa system kan vara intressanta mål för framtida läkemedel, säger han.

Bild: REUTERS / Brian Snyder, EPA / Facundo Arrizabalaga, AP Photo / Jose Luis Magana / TT
Så hanterar kroppens celler syrebrist
När samtalet från Stockholm kom satt han som bäst och filade på en EU-ansökan för ett samarbete med finska kolleger. Och han är djupt skeptisk till Brexit – men inte på grund av risken för minskad forskningsfinansiering eller för att det skulle blir svårare med forskningsutbyten mellan olika länder.
– Sådant går att kompensera för. Det som stör mig är att oavsett om situationen nu blir milt dålig, medium-dålig eller jättedålig, har jag svårt att se någon som helst fördel, säger han.
Har tillsammans byggt ett pussel
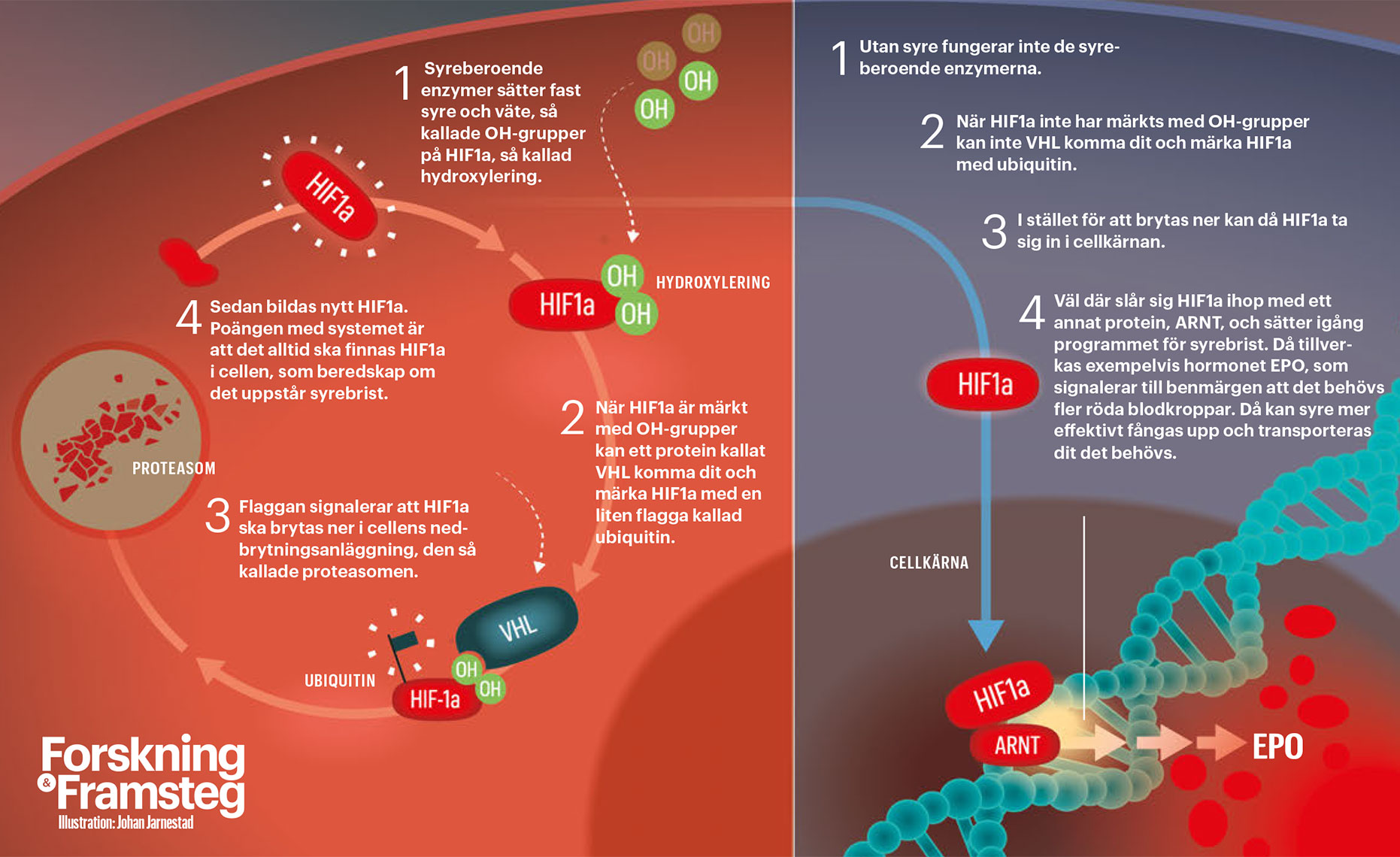
Det går att beskriva de tre pristagarnas arbete som att de stegvis, via flera oberoende upptäckter, tillsammans kunde bygga ett komplicerat pussel (se grafik). Den första biten lades redan under tidigt 1990-tal, då både Gregg Semenza och Peter Ratcliffe studerade hur den ovan nämnda EPO-genen styrdes vid olika syrenivåer. De fann då, på var sitt håll, att det i en mängd olika celltyper – inte bara i njuren där EPO normalt bildas – fanns sekvenser av arvsmassa som styr hur cellen reagerade på syre. Det pekade mot att det handlade om en universell mekanism.
Sedan upptäckte Gregg Semenza att en speciell så kallad transkriptionsfaktor var viktig för att reglera hur EPO bildades. Han kallade den HIF, efter engelskans hypoxia inducible factor. Samtidigt höll årets tredje pristagare William Kaelin på att forska om von Hippel-Landaus sjukdom. Det är en genetisk åkomma där patienterna drabbas av cancer på grund av en skada på en gen kallad VHL. Den genen visade sig även vara inblandad vid syrebrist, och han kunde visa att i frånvaro av den slogs systemet som reagerar vid syrebrist på. Peter Ratcliffe kunde sedan visa att det protein som bildas med VHL-genen som mall styr hur snabbt HIF bryts ner i cellen.
Publicerade samtidigt – men inte tillsammans
I slutet av 1990-talet hade de tre klarlagt hur det system som reagerar på syretillgång fungerar i normalfallet, alltså när cellen har tillgång till syre. Men fortfarande återstod att förstå hur cellen känner av syrebrist och då växlar läge. Det visade sig att speciella, syreberoende enzymer var de som satte fast så kallade hydroxylgrupper på HIF. Denna sista och avgörande pusselbit rapporterade William Kaelin och Peter Ratcliffe samtidigt, men inte tillsammans, i tidskriften Science år 2001.
Det kan i förstone verka väldigt slösaktigt att ha ett system som hela tiden bildar ett protein, HIF, som i de allra flesta fall bryts ner, för att det inte behövs. Men det visar på vikten av kroppens syrebrist-maskineri – när det väl behövs, ska det utan dröjsmål kunna slås på.