Den vanligaste metoden för att studera proteiner kräver att molekylerna är i kristallform. Kristallerna är mycket små, ofta ungefär en tiondels millimeter långa.
Bild: Deuteration and Macromolecular Crystallisation (ESS)
Nobelprisad teknik avslöjar virusets minsta delar
På rekordtid har forskare kartlagt viktiga proteiner hos det nya coronaviruset – kunskap som kan ge nyckeln till ett läkemedel. Bakom kartläggningen ligger två Nobelprisbelönade metoder, röntgenkristallografi och kryoelektronmikroskopi, och tålmodigt hantverk.
– Folk skämtar om att det är magi, säger biokemisten Zoë Fisher.
Hon har jobbat i många år med att analysera molekyler med en teknik som kallas röntgenkristallografi. Det är en av de två viktigaste metoderna som forskare använder sig av för att avbilda molekyler från coronaviruset sars-cov-2. Den andra är kryoelektronmikroskopi, som belönades med ett Nobelpris i kemi 2017.
Just nu har Zoë Fisher haft en intensiv period av arbete vid synkrotronljuskällan Max IV i Lund, där hon och hennes kolleger har jobbat med att analysera tre olika molekyler från coronaviruset.
Att Zoë Fisher blev inblandad i projektet var lite av en slump. När Storbritannien stängdes ned för att bromsa pandemin, blev forskaren Frank Kozielski, som annars brukar veckopendla till University College London, strandad i Lund. Han tog då initiativ till ett samarbete för att utforska några molekyler som har en viktig funktion i processen då viruset kopierar sig självt. Att oskadliggöra dem skulle kunna vara ett sätt att stoppa virusets förökning.
Började framställa coronaprotein
Zoë Fisher arbetar vid ESS, neutronforskningslaboratoriet som håller på att byggas utanför Lund, där hon leder en grupp som arbetar med stöd för experiment med biologiska molekyler (DEMAX). Hennes grupp, tillsammans med en grupp vid Lunds universitet som kallas LP3 (Lunds proteinproduktionsplattform), började genast arbeta med att framställa coronaprotein och göra kristaller som kunde undersökas vid synkrotronljuslaboratoriet Max IV.
Det svenska projektet är långt ifrån det enda. Under månaderna sedan världen fick upp ögonen för sars-cov-2 har många forskare gett sig på att avbilda olika molekyler som ingår i viruset.
Proteiner är komplicerade molekyler som är uppbyggda av kedjor av aminosyror. En proteinmolekyl består av tusentals atomer, ibland miljoner. Att bara veta vilka atomer som ingår räcker dock inte långt.
– Strukturen bestämmer funktionen, så det är viktigt att studera strukturen hos ett protein för att förstå hur det fungerar, säger Jie Nan, en av forskarna vid laboratoriet Max IV, som också var med och bidrog till den aktuella studien.
Måste förstå molekylerna i detalj
Om någon av ett proteins viktiga funktioner kan hämmas eller förstöras kan viruset stoppas – och nyckeln är då att förstå molekylerna i detalj. Ett intensivt arbete pågår, vilket bland annat syns i en central databas där forskare rapporterar in molekylstrukturer, och som under andra halvan av maj redan innehöll ungefär 170 proteinstrukturer från sars-cov-2.
Taggarna på utsidan till exempel, de som ser ut som små strutar på ytan, är virusets anfallsvapen. De består av ett speciellt protein som fungerar i två steg. Först känner det igen de celler som viruset kan invadera och använda sig av. Sedan bryter de upp den invaderade cellens hölje, det skyddande membranet. Virusets eget membran öppnas också, och virusets arvsmassa kommer in i cellen. Viruset använder sig sedan av cellens molekylära maskineri för att kopiera sig självt och skapa mer virus.
Forskarna behöver alltså lista ut hur de långa proteinmolekylerna är hopveckade, genom att ta reda på hur atomerna sitter i förhållande till varandra. Resultatet visas ofta i form av figurer som liknar färgglad spagetti.
Röntgenkristallografi är en gammal och väl etablerad metod. Ljus skickas mot en kristall, och den regelbundna strukturen i den gör att ljuset sprids i vissa riktningar och bildar ett mönster som avslöjar kristallens uppbyggnad. Den biten har man grundligt förstått sedan 100 år tillbaka. Nobelpriset i fysik 1914 och 1915 gick till några av de banbrytande upptäckterna bakom tekniken, och flera Nobelprisbelönade upptäckter har gjorts med just röntgenkristallografi.
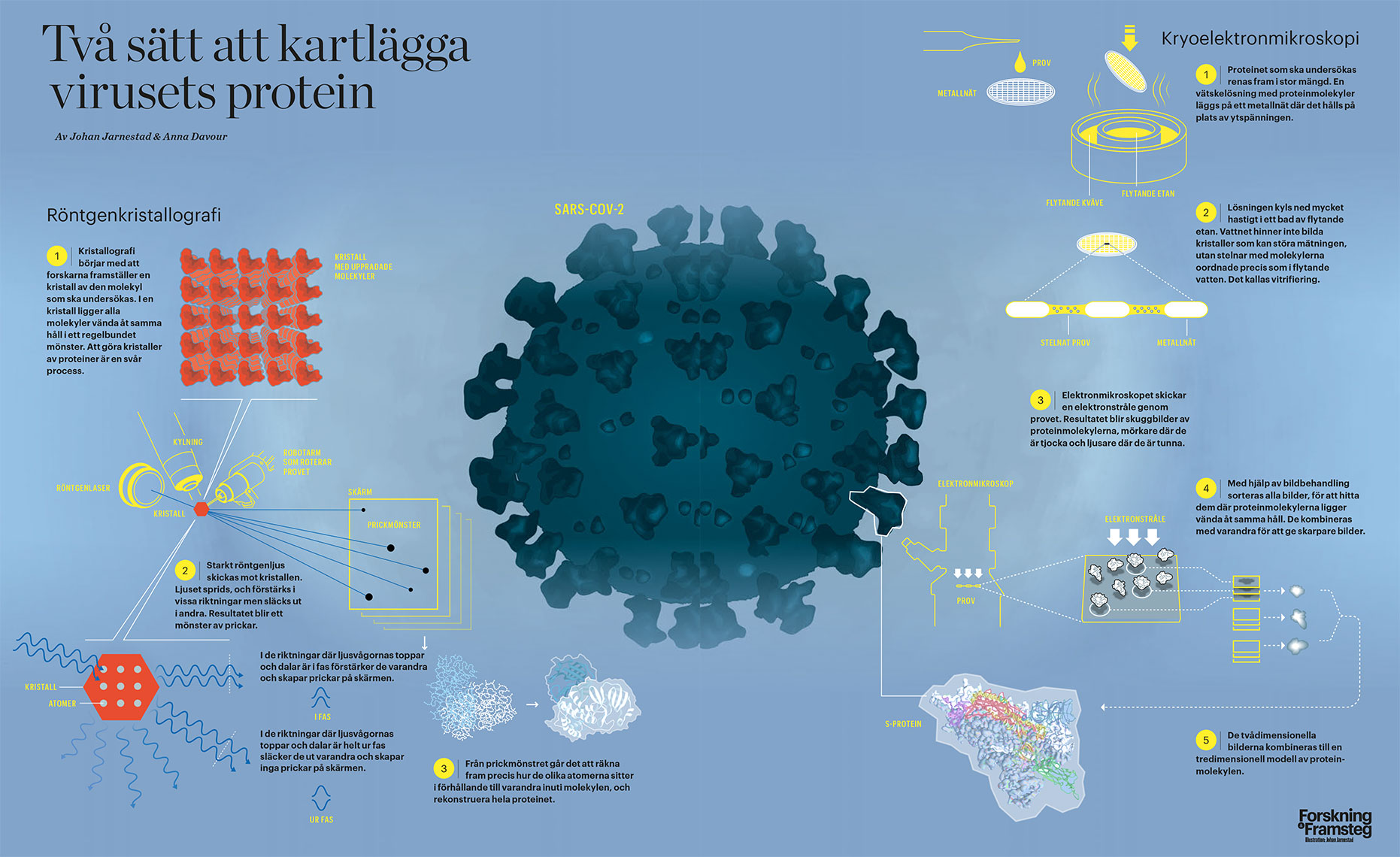
Två sätt att kartlägga virusets protein
Molekylerna i kristallform
Det är här vi kommer till magin som Zoë Fisher talar om. Den ligger i att få de stora och obändiga biologiska molekylerna att ordna sig i den kristallform som är själva förutsättningen för att metoden ska fungera.
Det kan vara svårt att tänka sig biologiska molekyler som kristaller, men en kristall är helt enkelt en struktur där molekylerna ligger uppradade intill varandra i regelbundna rader och kolumner, alla vända åt samma håll. Proteiner bildar inte så gärna kristaller, utan måste varsamt fösas ihop för att få igång kristalliseringen.
– Det finns inget recept, utan det är trial and error som gäller, berättar Zoë Fisher.
Hon beskriver hur hon brukar göra 96 experiment parallellt, med proteinmolekyler i lösning. Alla har små skillnader i surhetsgrad, koncentration av lösningsmedel och andra parametrar. Målet är att hitta ett perfekt läge där vattenmolekyler hålls undan från proteinmolekylerna, så att en molekyl hittar nästa molekyl att lägga sig intill och börja bygga upp en kristall.
När väl de rätta förutsättningarna har hittats händer det ändå att försöket behöver göras om några gånger innan forskarna lyckas få fram en perfekt kristall utan defekter.
Snabbspår på forskning på sars-cov-2
Numera har många laboratorier snabbspår för forskning på just sars-cov-2, så även Max IV. Så fort kristallerna var klara gick det fort att få tid vid en av experimentstationerna, där de bestrålades med det intensiva röntgenljuset som framställs med hjälp av en acceleratoranläggning.
En annan nymodighet under denna speciella tid är att alla experiment görs på distans.
– Det var första gången jag gjorde experiment på det sättet. Det var väldigt häftigt att se hur det funkade. Vi gjorde allt över internet, och kunde styra en robot som bytte ut proverna och stack in dem i röntgenstrålen, säger Zoë Fisher.

När mätningarna väl har gjorts är det en nästan helt automatiserad process att räkna fram molekylens struktur. Väl inarbetade algoritmer används i ett datorprogram för att räkna bakåt från ett abstrakt mönster av prickar till atomernas lägen i kristallen. Bara i vissa svåra fall behöver en expert ingripa för att få fram strukturen.
När Zoë Fisher och hennes kolleger i Lund hade gjort sina mätningar satt Frank Kozielski uppe hela kvällen och räknade fram strukturerna. Bara ett par dagar senare hade gruppen en nästan färdig rapport.
Kryoelektronmikroskopi – en annan metod
Men alla proteiner låter sig inte enkelt radas upp som kristaller. Då krävs andra metoder. En sådan är kryoelektronmikroskopi, där molekylerna får sväva fritt i en snabbfryst vattenlösning. Det påminner mer om de blöta och kaotiska omgivningar där molekylerna normalt verkar.
En detaljerad bild av taggarna på viruset sars-cov-2 togs fram med den här metoden av en grupp forskare vid universitetet i Austin, Texas, i USA, och publicerades i tidskriften Science i mitten av mars.
Lars-Anders Carlson, lektor vid Institutionen för medicinsk kemi och biofysik, Umeå universitet, är imponerad. Han jobbar själv med avbildningar av andra virusproteiner med samma teknik.
– Det gick extremt fort. De måste ha arbetat dygnet runt.
Molekylerna måste frysas hastigt
Det är nämligen inte bara att lägga viruset under ett mikroskop och ta ett fotografi.
Steg ett är att frysa in en lösning med proteinet som ska undersökas. Det måste göras hastigt och på ett sätt som gör att det inte bildas iskristaller som kan störa elektronstrålen. I stället stelnar vattnet med molekylerna helt oordnade, precis som i flytande vatten. Det kallas vitrifiering. En finess är att det vitrifierade vattnet inte avdunstar i det vakuum som omger provet inuti mikroskopet.
Mikroskopet avbildar provet med en stråle av elektroner, som har mycket kortare våglängd än vanligt ljus och därmed kan avbilda mindre detaljer. Strålen går genom provet och ger en sorts genomlysning av proteinmolekylerna i provet, ungefär som en röntgenbild.
Eftersom de kan flyta omkring vända åt olika håll i lösningen blir resultatet en stor mängd bilder av proteinet från slumpmässiga vinklar.
Bilderna pusslas ihop
Nu vidtar det svåra arbetet. Med hjälp av bildanalysteknik måste forskarna hitta flera bilder på proteinet från samma vinkel och lägga dem ovanpå varandra, för att kombinera dem till en skarpare bild. Andra proteinmolekyler ligger vända på ett annat sätt, och de pusslas ihop på samma vis. Resultatet blir en mängd tvådimensionella bilder ur olika vinklar.
De här bilderna kan sedan kombineras ihop till en tredimensionell avbildning av hur molekylen är uppbyggd.
Vissa av de här bildanalysstegen är delvis automatiserade, men det krävs ganska mycket hjälp av ett tränat öga för att pussla ihop det detaljerade slutresultatet.
– Det är ett hantverk, konstaterar Lars-Anders Carlson.

Kunskap baserad på vetenskap
Prenumerera på Forskning & Framsteg!
Inlogg på fof.se • Tidning • Arkiv med tidigare nummer