Bild: SPL / TT
Ny immunbehandling slår mot dödlig cancer
Låt kroppens eget immunförsvar bekämpa cancern. De senaste åren har olika typer av immunbehandling slagit igenom inom cancervården. Men de befintliga metoderna fungerar inte för alla former av cancer. Nu försöker svenska forskare dyrka upp motspänstiga tumörer.
De senaste åren har cancerbehandling som utnyttjar kroppens eget immunförsvar slagit igenom. Det har inneburit att cancer som tidigare har haft mycket dålig prognos kan behandlas och i vissa fall till och med botas. Mest utvecklad och använd är en form av immunterapi som hjälper vissa slags vita blodkroppar, så kallade T-celler, att både hitta och döda tumörceller. Detta sker enkelt beskrivet genom att lätta på en broms som hindrar dem att ge sig på cancerceller. Denna fiffiga mekanism skrev F&F om när forskarna bakom upptäckten belönades med Nobelpriset i fysiologi eller medicin 2018.
Immunterapi är i dag ett glödhett forskningsområde, där svenska forskare ligger långt framme. Att på olika vis få kroppens egna T-celler att bli bättre på att angripa tumörceller har visat sig vara en framkomlig väg för att komma åt allvarliga tumörformer. Men alla tumörer går inte att rå på med denna behandling.
– Tumörer kan delas upp i immunologiskt ”kalla” och ”varma”, vilket avspeglar hur pass mottagliga de är för immunterapi, säger Magnus Essand, professor vid Institutionen för immunologi, genetik och patologi vid Uppsala universitet.
Få eller rikligt med T-celler
Att en tumör är varm innebär att den har många T-celler i sin absoluta närhet, i den så kallade mikromiljön. Dessa celler kan potentiellt aktiveras av olika slags immunbehandling. I och runt en kall tumör, däremot, är det dåligt med T-celler.
– Då finns det få T-celler som kan aktiveras. Det är en faktor som ligger bakom att det ser så olika ut vad gäller hur immunterapi fungerar för olika tumörslag, säger han.
Den Nobelprisbelönade varianten av immunterapi kallas checkpoint-hämmare och är effektiv vid hudcancerformen spritt melanom, viss lungcancer, tjocktarmscancer, bröstcancer, cancer i urinblåsan, sarkom och ett slags lymfkörtelcancer. Men vid andra cancerformer fungerar de sämre eller inte alls, exempelvis vid prostatacancer eller hjärncancern glioblastom.
Bild: Getty images
Lyckligtvis finns det fler sätt att aktivera immunförsvaret. Mycket lovande är behandling med så kallade CAR-T-celler. Sådan behandling godkändes för leukemi och lymfom inom EU så sent som 2018. Av de svenska patienter som hittills har behandlats har de flesta, omkring 40 personer, fått sin behandling inom ramen för forskningsstudier. Ett tiotal personer, varav hälften barn, har fått behandling via sjukvården. Men den är kostsam – en behandling kostar drygt tre miljoner kronor. Den kan även ge svåra biverkningar, i de fall immunsystemet blir alltför upptrissat. Men när det fungerar är effekterna dramatiska. Mellan 30 och 40 procent blir botade och behöver ingen ytterligare behandling.
I en femårsuppföljning publicerad i New England Journal of Medicine 2018 beskrevs 53 patienter som fått CAR-T-behandling efter återfall av den allvarliga blodcancerformen akut lymfatisk B-cellsleukemi. De som inledningsvis hade mindre tumörmängd hade störst chans att botas av behandlingen, vilket skedde i ungefär hälften av fallen.
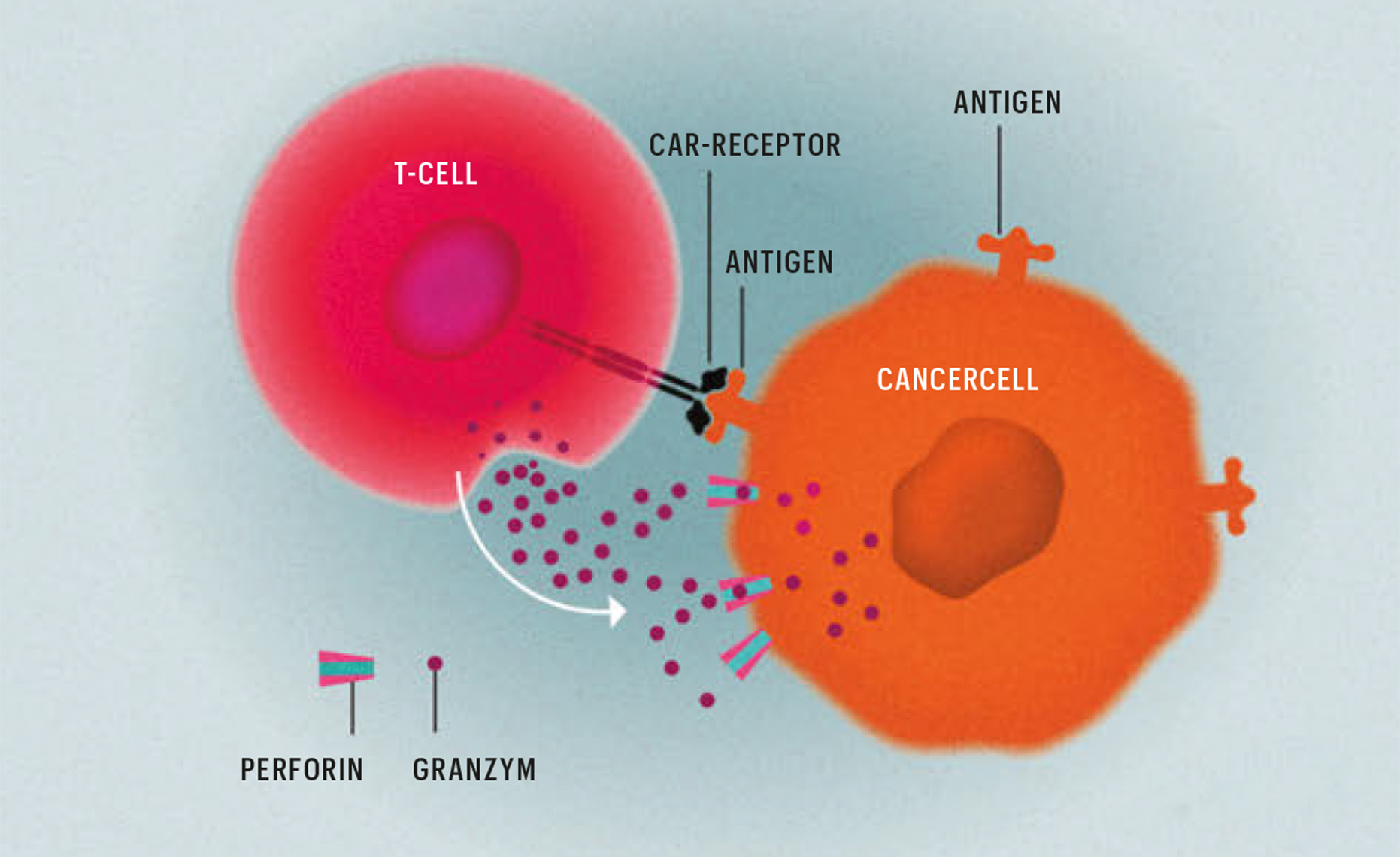
Så fungerar cancerdödaren CAR-T
Läkemedel av patientens egna T-celler
För att skapa läkemedlet utgår man från patientens egna T-celler. Via en komplicerad process skördas och anrikas dessa celler utanför kroppen, och därefter förses de med en receptor, som kallas chimär antigen receptor, CAR (se grafik). Därefter ges CAR-T-cellerna tillbaka till patienten via infusion. Väl på plats i blodbanan kan de med sin målsökande receptor hitta och döda tumörcellerna.
Angelica Loskog, professor vid Institutionen för immunologi, genetik och patologi vid Uppsala universitet, var den som först startade en klinisk studie där patienter i Sverige behandlades med CAR-T-celler 2014. Resultaten från de första 15 patienterna, som hade lymfom och B-cellsleukemi som inte svarade på gängse behandling, publicerades i Clinical Cancer Research 2018.
– När artikeln skrevs levde fortfarande två av patienterna. Med tanke på att dessa patienter har mycket dålig prognos är det ändå bra resultat, även om man innerst inne alltid önskar bot, säger hon.
Forskning om ännu mer effektiv CAR-T-behandling pågår och Magnus Essand gör försök med att ladda CAR-T-celler med extra ammunition, i form av en gen som kan bilda små molekyler. Dessa öppnar även immunologiskt kalla tumörer. Under 2022 ska denna form av CAR-T-celler användas i en studie för patienter med lymfcancer.
– Det är en helt ny generation av CAR-T-celler som vi har tagit fram och som vi är spända på att testa, säger han.
I ett annat projekt har han fått anslag för att utveckla behandling mot ett slags hjärncancer kallad glioblastom. I detta fall riktas CAR-T-cellerna mot ytproteinet IL13Ra2 som finns på just glioblastomceller. En utmaning är att mikromiljön inuti hjärnan dämpar T-cellernas aktivitet. Därför kommer CAR-T-cellerna även att förses med den extra genen för att skapa en varm tumör. Då skapas en inflammationsreaktion, som i sin tur aktiverar immunförsvaret.
– Då kan det egna immunförsvaret arbeta effektivare, och på egen hand aktivera andra T-celler i kroppen att attackera även cancerceller som saknar ytproteinet IL13Ra2, säger Magnus Essand.
Den första studien på människor blir en så kallad fas 1-studie, där de primära utfallsmåtten är att se att behandlingen inte är farlig eller ger för mycket biverkningar, samt att hitta rätt dos. Studien ska omfatta mellan sex och tolv unga patienter och inleds under 2024.
Hjälper patienter med ögonmelanom
En annan svensk forskare som arbetar med CAR-T-celler mot svårbehandlad cancer är Lars Ny, överläkare och docent inom onkologi vid Sahlgrenska universitetssjukhuset i Göteborg och avdelningschef för avdelningen för onkologi vid Göteborgs universitet. Tillsammans med en forskargrupp, ledd av professor Jonas Nilsson, riktar han in sig på att hjälpa en grupp patienter som har den mycket ovanliga cancerformen ögonmelanom. Denna sjukdom drabbar cirka 80 svenskar varje år. Hos ungefär hälften av fallen sprider den sig till levern, och då finns ingen effektiv behandling.
– Sjukdomen drabbar oftast personer över 60 år, men vi har även patienter som är i tjugoårsåldern, säger han.
Forskarna hoppas att speciella CAR-T-celler ska kunna göra susen. Den sort de har skapat, och som odlas i Göteborg i samarbete med ett företag i Köln i Tyskland, är riktade mot en ytmolekyl kallad HER-2. Det är en receptor som finns på vissa bröstcancerceller, men även i ökad mängd på de celler som har omvandlats vid ögonmelanom. En extra finess är att forskarna utgått från en speciell sorts T-celler som infiltrerar tumörer, så kallade tumörinfiltrerande leukocyter.
– Vi ville inte använda vilka T-celler som helst, utan tror att dessa kan vässa behandlingen, säger Lars Ny.
Studier på celler från bortopererade metastaser från människa och på tumörer i möss har gett bra resultat. Redan i dag får vissa fyrbenta cancerpatienter prova behandlingen. I samarbete med professor Henrik Rönnberg på Sveriges lantbruksuniversitet i Ultuna utanför Uppsala får hundar med slemhinnemelanom denna behandling.
– Hittills ser det lovande ut, säger Lars Ny.
En studie för patienter med ögonmelanom planeras att starta i år och Lars Ny är hoppfull.
– På sikt tror jag att CAR-T-cellbehandling kan vara en framkomlig väg för denna utsatta patientgrupp, säger han.
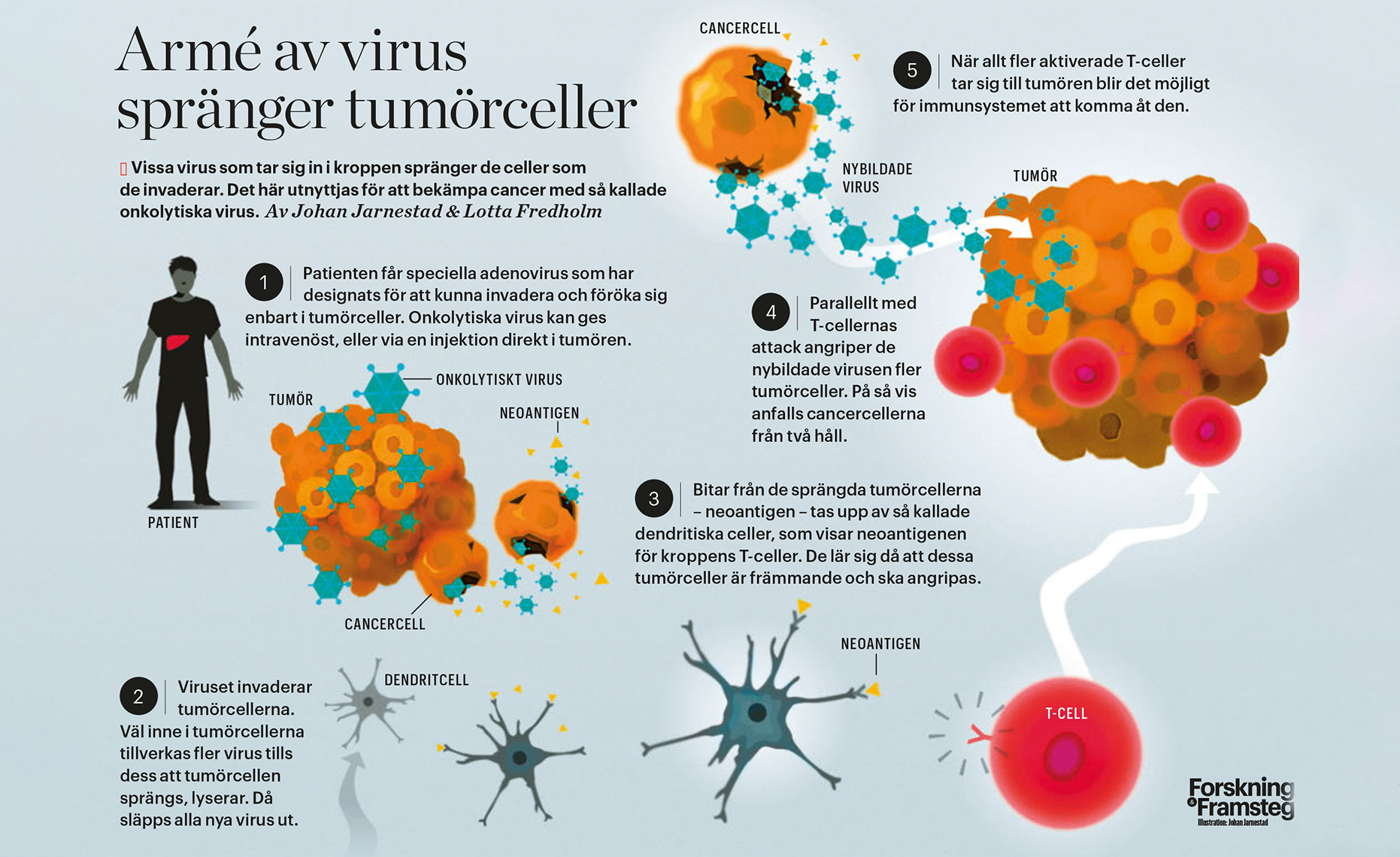
Armé av virus spränger tumörceller
Spränger tumörceller inifrån
En helt annan typ av immunbehandling går ut på att spränga tumörcellerna inifrån och här används så kallade onkolytiska virus (se grafik). I sin normala livscykel tar sig virus in i värdceller, kapar värdens cellmaskineri och använder det för att tillverka en mängd kopior av sig själv. Vissa virus ger sig stillsamt av från värdcellen, medan andra spränger, lyserar, cellen inifrån. Det är denna mekanism som här utnyttjas för att komma åt tumörcellerna – därav namnet ”onkolytiska”.
Magnus Essand började intressera sig för onkolytiska virus under sin postdok i USA i slutet av 1990-talet, då han kartlade ytmarkörer på prostatacancerceller som virus skulle kunna riktas mot. Han tog med sig tekniken till Uppsala, där han nu leder en studie med patienter med så kallade neuroendokrina tumörer. Dessa tumörer kan uppstå i olika delar av kroppen men om de väl har spritts till levern är de svåra att bota med kirurgi. Patienterna får behandling med onkolytiska virus som har anpassats för att hitta just dessa tumörer. Tekniken har beskrivits i tidskriften Neuroendocrinology.
I studien får deltagarna specialdesignade virus av typen adenovirus injicerade i levern, via en kateter i ljumsken.
– Med hjälp av ultraljud ser vi att de hamnar i rätt del av levern. De adenovirus vi använder kan inte föröka sig i friska celler, utan bara i tumörceller, säger Magnus Essand.
Förutom att tumörcellerna dör, innebär det faktum att de lyserar en ytterligare fördel, eftersom det blottar en massa tumörspecifika proteinbitar som då blir synliga för immunsystemets celler.
– Dessa kallas neoantigen och genom att exponera dem för immunsystemet kan kroppens egna T-celler aktiveras att söka efter tumörceller som uttrycker neoantigen, säger han.
Studien inleddes 2016, men stod still under 2020, delvis på grund av coronapandemin.
– Nu har vi kört igång igen och behandlade i veckan patient nummer sju och räknar med att sammanlagt inkludera tolv patienter. Hittills har vi inte sett några allvarligare biverkningar, bara influensaliknande symtom, säger Magnus Essand.
I denna fas 1-studie vill forskarna se att behandlingen inte är farlig eller ger allvarliga biverkningar plus hitta rätt dos virus att ge i kommande studier.
– Det är huvudsyftet, men självklart dokumenterar vi även effekter på tumören, men där finns i dag ingen effektiv behandling att jämföra med, säger Magnus Essand.
Behandlat patienter med prostatacancer
Han nämner även en annan fas 1-studie i samarbete med forskare i Nederländerna, där tolv patienter med spridd prostatacancer behandlats med ett annat onkolytiskt virus.
– Det var det första virus vi byggde och det som jag började jobba med då jag kom tillbaka efter min postdok. Studien är klar men ännu inte publicerad, så det jag kan säga såhär långt är att vi inte såg någon allvarlig toxicitet, säger han.
Även Angelica Loskog arbetar med onkolytiska virus, både akademiskt och i kliniska studier. Längst fram ligger en studie som pågår i USA, där hon tillsammans med ett läkemedelsföretag undersöker om ett onkolytiskt virus i kombination med checkpoint-hämmare kan vara effektivt vid bukspottkörtelcancer. Denna tumörform har mycket dålig prognos eftersom de inte ger några symtom förrän cancern redan har spritt sig. Då är det för sent att operera bort den och inte heller vanlig immunterapi fungerar.
I studien ingår 45 patienter. Den ena gruppen får virus ihop med standardbehandling, resterande får också detta, men med extra tillägg av checkpoint-hämmare.
– Studien inleddes 2016 och då den är den första i sitt slag går det väldigt långsamt, eftersom vi bara tar in en patient i taget, säger hon.
Enligt Angelica Loskog ser det lovande ut, särskilt kombinationen med checkpoint-hämmare. Just detta virus har hon även patenterat inom ett företag hon driver. Förhoppningen är att på något års sikt inleda en så kallad registreringsstudie som kan leda till marknadsgodkännande. Ansökan om studien görs både till den amerikanska läkemedelsmyndigheten Food and Drug Administration och till European Medicines Agency.
– Om denna blir godkänd blir det en så kallad multicenterstudie. Dessa brukar omfatta omkring 40 deltagande sjukhus runtom i världen, och vi vill ha med några kliniker i Sverige, säger hon.
Hon beskriver att hon som forskare inte träffar patienter, men att det ändå är dem hon har för ögonen. I morgon-TV hösten 2020 mötte hon en av de svenska patienter som i de inledande akademiska försöken fått behandling mot sin bukspottkörtelcancer.
– Det var stort att träffa någon som hade fått en dödsdom, men som levde tack vare vår forskning. Mina akademiska forskningsprojekt har fokus på att ta fram bättre verktyg att kunna använda kliniskt, och mitt främsta mål är att kunna hjälpa någon, säger hon.

Kunskap baserad på vetenskap
Prenumerera på Forskning & Framsteg!
Inlogg på fof.se • Tidning • Arkiv med tidigare nummer