Bild: AMI Images / SPL
Genteknikens andra revolution
Bakterier har ett avancerat system för att känna igen generna hos fientliga virus. Den upptäckten har gett forskarna helt nya möjligheter att med stor precision ändra arvsmassan hos levande organismer. Klarar vi av att hantera den förmågan?
Tvillingsystrarna Ningning och Mingming är två mycket speciella apor. De är födda i Kunming i södra Kina och har – som alla makakungar – stora ögon och fjunigt hår. Det speciella med tvillingarna är att de är levande bevis för att en ny metod för att redigera arvsmassa fungerar även på primater.
Metoden bygger på ett biologiskt maskineri som kallas crispr och som är på god väg att revolutionera gentekniken. Sedan början av år 2013 har crispr-tekniken spritt sig till tusentals laboratorier runt om i världen. Den är snabb, enkel och billig. Genforskarna beskriver den som ett av de största framstegen inom konsten att klippa och klistra i arvsmassa sedan det i början av 1970-talet blev möjligt att flytta dna från en art till en annan.
Det var alltså i början av förra året som metoden för första gången testades i experiment på odlade celler från människor och möss. Den har även använts på bakterier, jäst, ris, majs, vete, insekter, fiskar och många andra arter. Med crispr har det blivit möjligt att förändra arvsmassan i stort sett hur som helst hos vilken typ av organism som helst.
Aporna Ningning och Mingming bär på två mutationer som kinesiska forskare förde in i befruktade ägg. Systrarna mår bra. Syftet med försöket var att testa tekniken. En möjlig tillämpning är att använda genförändrade apor för att utveckla nya sätt att behandla ärftliga sjukdomar hos människor.
– Det händer ofta att läkemedel som fungerar på möss är verkningslösa på människor. Försök på apor är mycket mer tillförlitliga, säger Xingxu Huang, professor i genetik och utvecklingsbiologi vid Nanjing university i Kina.
Tidigare försök att genförändra apor har krävt åratal av arbete, och lett till att nytt dna hamnar på slumpvisa ställen i apornas arvsmassa. Med hjälp av crispr lyckades Xingxu Huang och hans medarbetare för första gången förändra arvsmassan hos primater med god precision.
Försöket väcker många etiska frågor, inte minst på grund av att det kan bli möjligt att förändra människors arvsmassa på samma sätt. Forskarna bakom Ningning och Mingming har inga sådana planer, och det finns en liten risk för att genförändringarna hamnar på fel ställen i arvsmassan.
– Säkerheten och noggrannheten måste bli bättre, men resultaten visar på en potential för behandling av ärftliga sjukdomar, säger Xingxu Huang.
I likhet med många andra riktigt stora vetenskapliga genombrott har det nya gentekniska verktyget sina rötter i grundforskning utan sikte på praktiska tillämpningar.
Historien börjar år 1987 i Japan. En grupp forskare vid universitetet i Osaka studerade dna från vanliga tarmbakterier och upptäckte ”en ovanlig struktur”. Kedjan av kemiska bokstäver i arvsmassan innehöll korta upprepade sekvenser åtskilda av andra korta sekvenser som var till synes helt slumpmässiga. Vilken funktion kunde detta mönster tänkas ha?
Fler och fler snarlika strukturer dök upp i både bakterier och arkéer (som i likhet med bakterier saknar cellkärna men utgör en egen domän i livets träd). Inget liknande har upptäckts hos vare sig djur, växter eller andra organismer med cellkärna.
De märkliga strukturerna fick namnet crispr, och forskare lanserade den ena teorin efter den andra om vad strukturerna gör i en levande cell.
Först år 2005 kom förklaringen. Då upptäckte tre olika forskargrupper att de åtskiljande sekvenserna ofta liknar virus-dna, och föreslog att crispr kunde vara en del av någon sorts immunsystem. Det finns massor av virus som angriper både bakterier och arkéer.
Hur immunsystemet fungerar avslöjades år 2007 av företaget Danisco, som säljer tillsatser till livsmedelsindustrin. Bland mycket annat levererar företaget bakterier till mejerier som gör yoghurt och ost. Om bakterierna blir smittade av virus kan produkterna få dålig smak och konsistens.
Företagets forskare upptäckte att ett fåtal bakterier av arten Streptococcus thermophilus – som används i yoghurt – överlevde ett virusangrepp. Det visade sig att överlevarna hade sparat bitar av virusets arvsmassa, och därmed blivit immuna mot viruset. Minnet av angriparna fanns i den ovanliga strukturen crispr – som alltså är ett slags genetisk databas med signalement på inkräktande virus.
Det var nyttig kunskap. Företaget har nu börjat utsätta sina bakterier för vanligt förekommande virus för att göra dem tåligare, och därmed undvika problem i mejerierna.
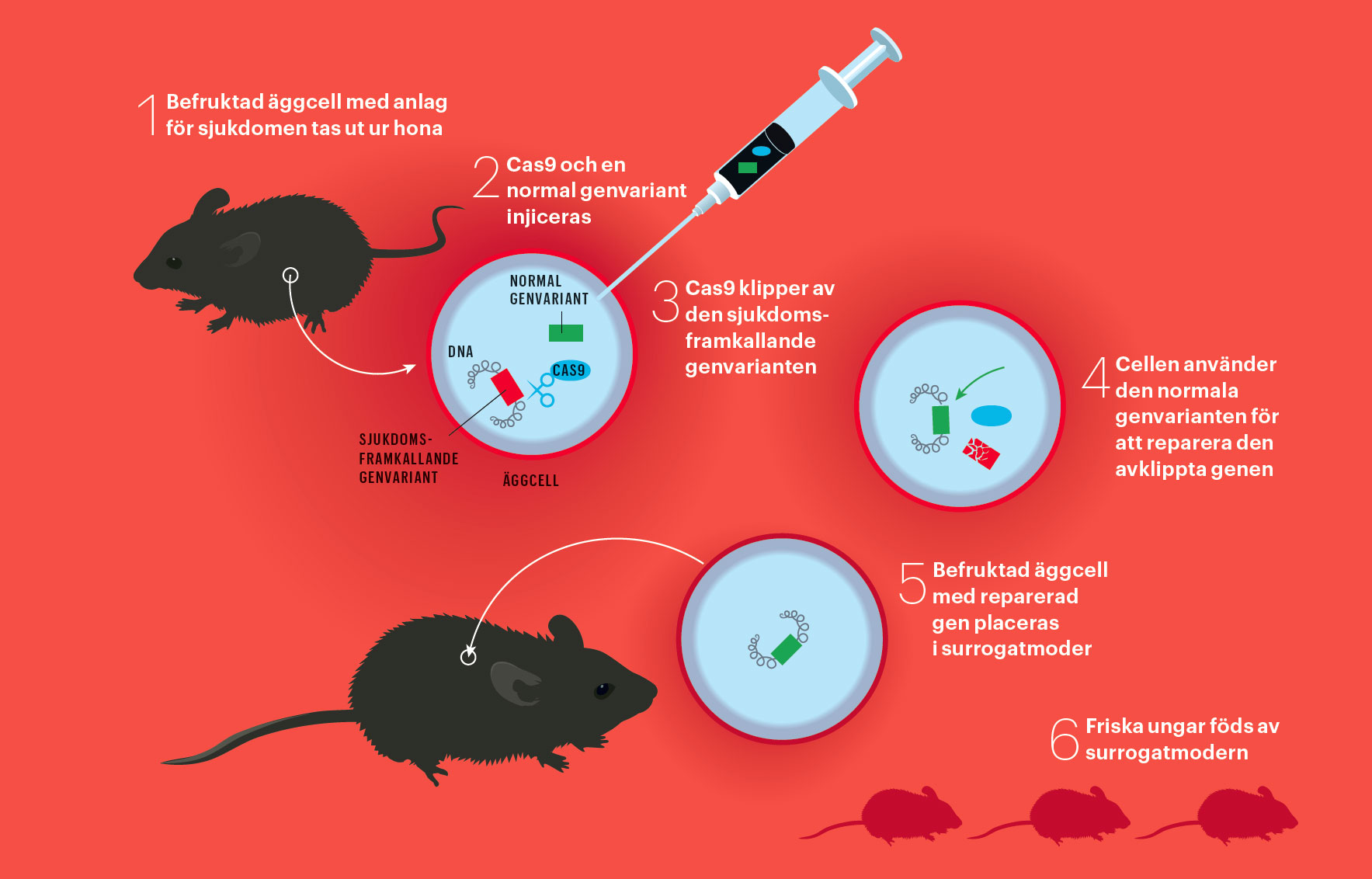
Att byta ut en sjuk gen mot en frisk
Bild: Johan Jarnestad
Andra forskare blev fascinerade av att encelliga organismer har ett så komplext och elegant försvarssystem mot virus. En viktig del av försvaret är enzymet Cas9, en målsökande sax som klipper av inkräktares arvsmassa. Avgörande upptäckter om hur Cas9 fungerar gjordes i Umeå.
– Vi hade arbetat med enzymet i ett par år innan det stod klart hur användbart systemet är, säger Emmanuelle Charpentier, docent i medicinsk mikrobiologi vid Umeå universitet.
Enzymet Cas9 sköter grovjobbet. Crispr, databasen med dna, skickar ut signalement på fientliga virus i form av rna-molekyler, som är ett slags arbetskopior av dna med uppgift att transportera genetisk information kors och tvärs i en cell.
Enzymet Cas9 fångar upp molekylen och använder den för att söka rätt på virus-dna som matchar signalementet. När Cas9 får en träff knipsar det av virusets arvsmassa.
Sommaren 2012 kom ett viktigt genombrott. Emmanuelle Charpentier och hennes medarbetare visade i provrörsexperiment att de kunde styra Cas9 med ett konstgjort rna-signalement så att enzymet kapade en dna-molekyl på önskat ställe.
– Det var fantastiskt! Då visste vi att vi hade ett användbart verktyg, säger Emmanuelle Charpentier, som sedan i fjol arbetar på Helmholtz-Zentrum für Infektionsforschung i Tyskland, men har en forskargrupp kvar i Umeå.
Nästa steg var att försöka ändra på arvsmassan i en levande cell med den nya tekniken. Två forskargrupper visade i februari förra året att det fungerar alldeles utmärkt. De kunde programmera saxen så att den klipper av vilken gen som helst i odlade mänskliga celler.
En cell som får arvsmassan avklippt är illa ute. För att överleva måste den reparera skadan. Den enklaste typen av lagning leder ofta till att en reparerad gen förblir avstängd. I laboratoriet kan det vara en fördel.
Forskarna har länge använt olika metoder till att stänga av gener för att ta reda på vad generna gör. Det är som att slå av olika strömbrytare för att ta reda på vilka lampor de är kopplade till. Den nya metoden gör att det nu bara tar veckor att stänga av gener i djur – i stället för flera år, som krävdes tidigare.
Dessutom har en mer raffinerad metod utvecklats. Det visade sig nämligen att om Cas9 förs in i cellen, tillsammans med en liten bit nytt dna som liknar den avklippta arvsmassan, så repareras skadan med den nya biten. På så vis kan praktiskt taget vilken förändring som helt göras: gener kan helt tas bort, bytas ut mot andra eller förändras på alla tänkbara sätt.
De vetenskapliga tidskrifterna Science och Nature utsåg genförändringar med crispr/Cas9 till ett av de största genombrotten år 2013, och det nya verktyget har fått stort genomslag inom biologi, bioteknik och medicin. Flera forskargrupper hoppas att tekniken i framtiden ska ge nya botemedel mot ärftliga sjukdomar. Några av forskarna i USA som visade att tekniken fungerar på mänskliga celler startade nyligen företaget Editas medicine som ska utveckla nya sätt att behandla sjukdomar genom att redigera arvsmassa.
Så kallad genterapi går ut på att behandla sjukdomar genom att föra in nya gener i kroppens celler. Försök med olika former av genterapi har pågått länge, men metoderna har varit osäkra och svåra att använda. Nu testas Cas9 på både djur och mänskliga celler i laboratorier runt om i världen.
Vuxna möss med leversjukdomen tyrosinemi orsakad av en trasig gen fick sprutor med Cas9 och dna-bitar med en intakt version av genen. Sjukdomen drabbar även människor. Efter behandlingen hade ungefär en tredjedel av levercellerna den intakta genen. Det räckte för att bota sjukdomen, enligt en forskargrupp vid Massachusetts institute of technology, MIT, i USA.
I Nederländerna samlade forskare in stamceller från patienter med cystisk fibros, en allvarlig ärftlig sjukdom som bland annat innebär att segt slem hamnar i lungorna och ökar risken för luftvägsinfektioner. I provrör ersatte forskarna en trasig gen med en hel. I teorin borde det vara möjligt att föra tillbaka reparerade stamceller i kroppen och därmed bota cystisk fibros. I praktiken är det dock svårt, bland annat på grund av att genskadan påverkar vävnader på många håll i kroppen.
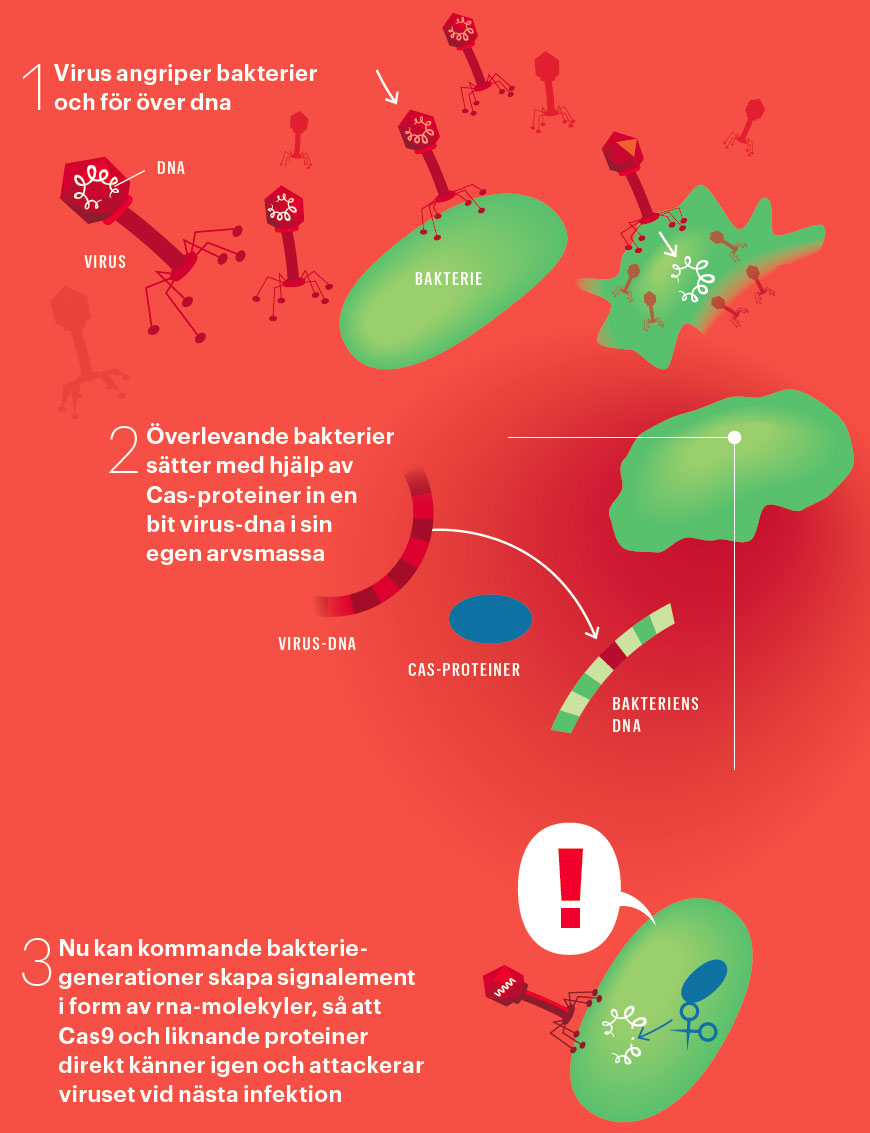
Bakterier skapar bilder av sina angripare.
Bild: Johan Jarnestad
Ett alternativ som testas i djurförsök är att bota ärftliga sjukdomar redan på äggstadiet så att sjukdomsanlaget försvinner en gång för alla. Det första lyckade exemplet kom från Kina i slutet av förra året och gäller möss med en genskada som orsakar grå starr. Så fort en nyfödd unge med sjukdomen öppnar ögonen syns det att linsen är grumlig, och mutationen går i arv från generation till generation. Forskare i Kina reparerade den trasiga genen i befruktade musägg, och satte in embryon i mushonor som födde friska ungar. Linserna i deras ögon var klara. Och de nya mössens ungar föddes också med friska ögon. Men inte alla reparerade äggceller utvecklades till fullgångna ungar.
– Om Cas9 ska användas för att behandla människor måste metoden fungera varje gång och vara utan biverkningar. Vi arbetar för närvarande med att öka effektiviteten, säger Jinsong Li, professor i biokemi och cellbiologi vid Shanghai institute for biological sciences och en av forskarna bakom försöket.
Men steget till att genförändra mänskliga ägg är mycket stort. I Sverige och de flesta andra länder är det förbjudet, och det finns andra sätt att hindra svåra ärftliga sjukdomar från att gå i arv från generation till generation. Så kallad preimplantatorisk genetisk diagnostik innebär att man i samband med en provrörsbefruktning väljer ut ett embryo som inte bär på en känd sjukdomsgen. Sådan diagnostik utförs ungefär hundra gånger per år i Sverige.
I en mer avlägsen framtid kan man tänka sig genförändringar som inte syftar till att korrigera ett genetiskt fel, utan till att föra in en ny önskad egenskap, till exempel motståndskraft mot hiv. I takt med att tekniken utvecklas blir det alltmer angeläget med etiska diskussioner om hur den bör användas.
En annan svår fråga gäller apor. Vi vet redan att crispr/Cas9 fungerar på makaker. I dag är genförändrade möss viktiga i utvecklingen av nya läkemedel. För vissa sjukdomar uppstår problem på grund av de biologiska skillnaderna mellan möss och människor. Det gäller i synnerhet sjukdomar i det centrala nervsystemet. Genförändrade apor kan ge helt nya möjligheter att hitta behandling mot neurologiska och psykiatriska sjukdomar. Samtidigt är experiment på apor etiskt vanskliga just därför att apor är så lika oss människor.
Den nya kunskapen är användbar även för annat än att redigera arvsmassan hos levande organismer, till exempel för att spåra utbrott av tuberkulos och andra infektionssjukdomar. Det är möjligt tack vare att crispr-systemet är adaptivt, det vill säga att bakterier kan lära sig att känna igen nya virus och bli resistenta mot dem. Det påminner om hur människor och andra djur utvecklar antikroppar som gör oss immuna mot ny smitta. En väsentlig skillnad är att bakteriernas adaptiva immunitet lagras i arvsmassan, vilket innebär att den går i arv till kommande generationer. Så är det inte med våra antikroppar.
Bakterier sparar bitar av dna från virus i crispr-regionen som en kronologisk lista över i vissa fall många hundra virus som infekterat cellen och dess anfäder. Att regionen förändras så fort är användbart. Genom att avläsa crispr-regionens arvsmassa går det att skilja bakterier åt som annars är helt identiska, och därmed att kartlägga hur bakterier har spritt sig.
Ur ett evolutionärt perspektiv är crispr lite av en udda fågel. Alla livsformer förändras i enlighet med Charles Darwins evolutionsteori: arvsmassan förändras slumpmässigt, och sedan gör det naturliga urvalet att förändringarna bevaras eller försvinner. Men crispr-systemets förändringar är inte alls slumpmässiga, utan snarare en anpassning till miljön.
Det ligger i linje med den franske biologen Jean-Baptiste de Lamarcks tankar om arternas utveckling från tidigt 1800-tal. Han föreslog att organismer anpassar sig till omgivningen under livet, och att dessa anpassningar sedan går i arv till avkomman. Lamarcks teori är generellt sett helt fel. Men crispr-systemet visar att han ändå hade en poäng, i alla fall i några specialfall.
Ungefär hälften av alla bakterier och nästan alla arkéer är utrustade med crispr. Upptäckten ger en ny bild av hur de samspelar med virus, vilket har stor betydelse inom både ekologi och medicin.
Bakterier har flera försvarslinjer mot inkräktare. Redan för ett halvsekel sedan upptäckte forskarna att bakterier har så kallade restriktionsenzymer som klipper av arvsmassan hos virus. Men till skillnad från crispr-systemet kan restriktionsenzymerna inte lära något av en virusattack. De fungerar som en sax som alltid klipper av dna-molekyler vid en given följd av kemiska bokstäver. Trots den begränsningen var olika restriktionsenzymer helt avgörande för genteknikens genombrott på 1970-talet, och ledde till ett Nobelpris år 1978.
Det har bara gått drygt ett år sedan det visade sig att crispr-systemet kan användas inom gentekniken. Det har redan lett till att forskare förändrat arvsmassan hos levande organismer på sätt som tidigare var omöjliga eller krävde många år av hårt arbete.
En dröm för Darwin?
Tre frågor till Magnus Lundgren.
1 | Hur kan det här användas på människor?
– Jag tror att de första tillämpningarna blir behandling av ärftliga sjukdomar som orsakas av en enstaka genförändring, om kanske 10–15 år.
2 | Är det aktuellt med ett Nobelpris?
– Det är möjligt, men det är först om flera år som vi ser den verkliga betydelsen. Många är inblandade, men eftersom bara tre kan dela på priset gissar jag i så fall på Philippe Horvath för upptäckten, och Emmanuelle Charpentier och Feng Zhang för tillämpningen.
3 | Vad skulle Charles Darwin säga?
– Han skulle vara fascinerad!
Om forskaren: Magnus Lundgren

Magnus Lundgren är mikrobiolog på institutionen för cell- och molekylärbiologi vid Uppsala universitet. Han leder en forskargrupp som studerar hur bakteriernas nyupptäckta immunsystem fungerar. En av komponenterna i systemet, som kallas Cascade, har han kartlagt i samarbete med forskare i Nederländerna.
Databas om fiender
Bakterier kan lagra information om fientliga virus genom att spara en bit av virusets dna i en del av sin egen arvsmassa som kallas crispr. Förkortningen står för clustered regularly interspaced short palindromic repeats.