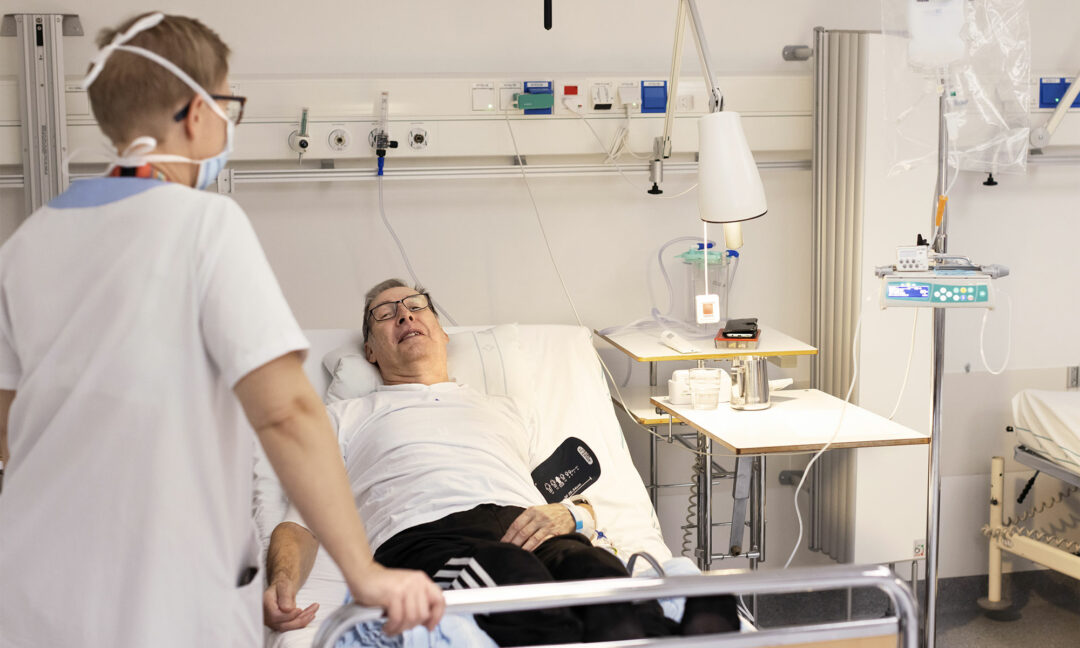
På Norrlands universitetssjukhus i Umeå får David Olofsson dropp med gensaxen Crispr.
Bild: Elin Berge
David har Skelleftesjukan – behandlas med gensaxen Crispr
Via en slang i armen får David Olofsson dropp med den Nobelprisbelönade gensaxen Crispr. Lyckas försöket klipps genen som gett honom Skelleftesjukan av.
Klockan är strax före åtta på morgonen. David Olofsson, pensionerad taxichaufför från Storuman, ligger i en sjuksäng med plastslangar kopplade till båda armarna och väntar på att experimentet ska börja. Han ingår i ett försök med en ny behandling mot Skelleftesjukan.
– För mig började det någon gång 2018 med domningar längst här ute i fingertopparna, säger David Olofsson.
Inget att bry sig om tänkte han då. Sedan blev det värre och spred sig till fötterna.
– Det kändes lite som att gå på kuddar.
Så småningom sökte han vård. Strax efter midsommar 2020 fick han diagnosen. Året därpå kände han att benmusklerna blivit så svaga att han motvilligt bestämde sig för att sälja sin motorcykel, en BMW R1200RT. Och i somras fick han en pacemaker eftersom sjukdomen i hans fall även påverkat hjärtat.
Skelleftesjukan är ärftlig
Skelleftesjukan är ärftlig och beror på att felveckade proteiner bildar trådar som tränger in i nerver, hjärta, ögon och andra organ. Det normala förloppet är en långsam försämring som till slut är dödlig.
Den nya behandlingen är riktad mot själva grundproblemet. Ett dropp ska ta bort det skadliga proteinet genom att stänga av en gen inne i leverns celler.
Droppåsen hänger i ett stativ av rostfritt stål bredvid sängen. Vätskan är grumligt gråblek.
David Olofsson berättar att han vaknade tidigt i morse och är lite spänd inför experimentet. Fem forskningssjuksköterskor gör sitt bästa för att sprida lugn med småprat om barnens tandläkarbesök och vinterunderhåll av sommarstugor medan de tar tempen, mäter blodtryck och tar dagens första blodprover. Som en del av proceduren blir David Olofsson ombedd att ännu en gång rabbla sitt personnummer.
Så är det dags. Lina Wiss samordnar förmiddagens experiment här på Norrlands universitetssjukhus. Hon möter David Olofssons blick.
– Är du redo?
– Jodå. Det är väl ett vanligt dropp, säger David Olofsson. Så skrattar han till:
– Eller ganska ovanligt förstås!
– Ja, ganska ovanligt, säger Lina Wiss.
Hon antecknar klockslaget 08.12 och trycker på en knapp så att vätskan börjar flyta från den hängande påsen genom en plastslang till Davids vänstra underarm. Under de kommande timmarna ska tre deciliter av lösningen in i hans kropp.
Förärades Nobelpris 2020
Experimentet ingår i världens första försök att hejda en ärftlig sjukdom med gensaxen Crispr/Cas9 direkt i blodomloppet. Idéerna bakom metoden utvecklades av den franska mikrobiologen Emmanuelle Charpentier medan hon var gästforskare här i Umeå. För den insatsen fick hon Nobelpriset i kemi år 2020.
Priset delade hon med den amerikanska molekylärbiologen Jennifer Doudna, medgrundare till företaget Intellia som tillsammans med bioteknikjätten Regeneron finansierar den kliniska studien där David Olofsson ingår.
Umeå är ett av studiens tre center. De övriga deltagarna är i Storbritannien och Nya Zeeland. Samtliga har ärftlig transtyretinamyloidos, i Sverige mer känd som Skelleftesjukan. Namnet beror på att de flesta svenskarna med sjukdomen finns i trakten av Skellefteå och Piteå.
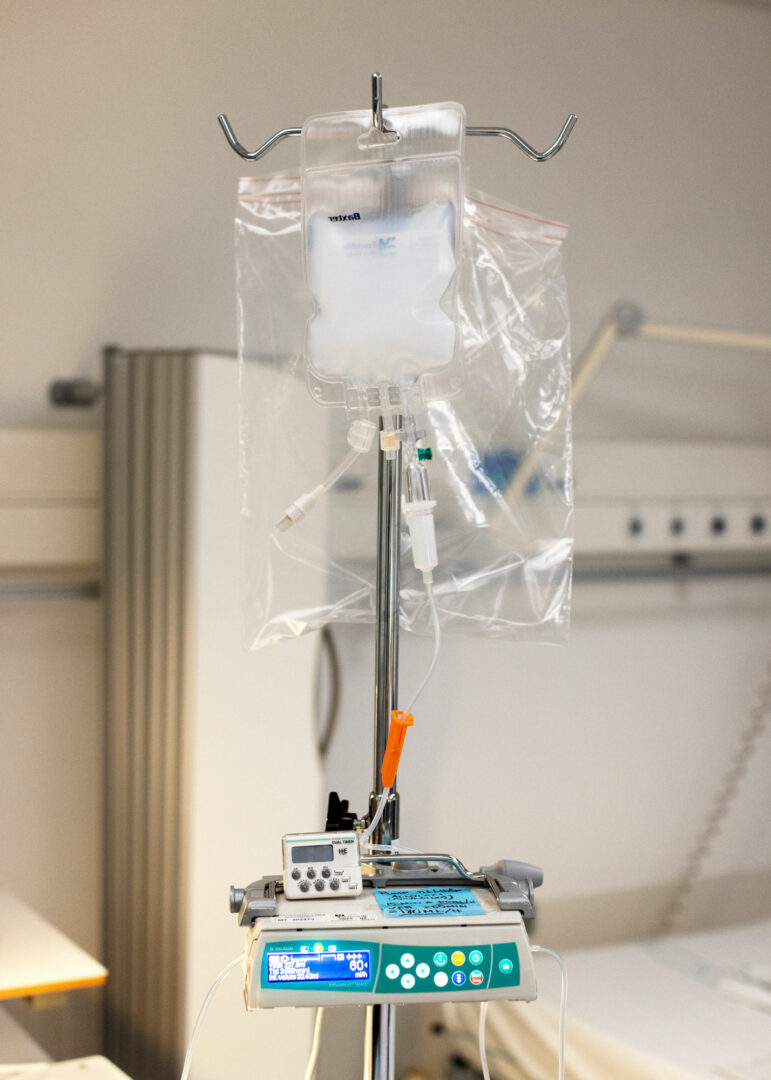
Bild: Elin Berge
Sammanlagt kommer 72 patienter i tre länder att delta i en så kallad fas 1-studie, som främst går ut på att hitta rätt dos och studera säkerheten. En rapport om de första sex patienterna från i fjol uppgav att droppet bara orsakade lindriga biverkningar som huvudvärk, illamående och svullnad. Men det finns alltid risker. Främmande ämnen i blodbanan kan påverka levern, immunsystemet och många andra kroppsfunktioner.
Eftersom människor är olika är det viktigt att ta reda på så mycket som möjligt om hur kroppen reagerar i varje enskilt fall. Det är därför en rullvagn med fjorton kartonger fulla av provrör med färgglada lock är parkerad intill David Olofssons säng. Vid förutbestämda klockslag under själva behandlingen och i ytterligare tre dagar kommer personalen att fylla rören med prover för mängder av analyser.
Risk att gensaxen klipper fel
En av farhågorna är att gensaxen ska klippa fel. Tekniken bygger på att ett slags genetiskt signalement (en specialgjord rna-molekyl) vägleder saxen (enzymet Cas9) till den gen som orsakar Skelleftesjukan.
Ett felaktigt klipp kan i värsta fall orsaka en tumör. Tidigare experiment på odlade leverceller har inte avslöjat några sådana felklipp, men forskarna kommer för säkerhets skull att fortsätta kalla in David Olofsson och de andra försöksdeltagarna för regelbundna provtagningar under flera år.
Levercellerna använder den aktuella genen för att tillverka proteinet transtyretin. Proteinet är inte livsnödvändigt, men hjälper kroppens celler att ta upp vitamin A och sköldkörtelhormon.
Tyvärr är transtyretin kemiskt instabilt. Naturligt åldrande leder hos enstaka personer till att det blir felveckat och trasslar ihop sig till långa trådar (amyloidfibriller).
Hos patienter med Skelleftesjukan beror trasslet på en mutation. En muterad variant av genen för transtyretin i enkel uppsättning hos någon av föräldrarna räcker för att både söner och döttrar ska löpa en 50-procentig risk att ärva mutationen. Men många anlagsbärare förblir friska. Vid 70 års ålder har mindre än hälften fått en diagnos.
I hela Sverige lever ungefär 400 människor med Skelleftesjukan.

Bild: Elin Berge
– Mer än hälften av dem bor i Norrbotten och Västerbotten, säger Björn Pilebro, överläkare i kardiologi vid Norrlands universitetssjukhus och ledare för den svenska delen av studien.
Den muterade genens begränsade genomslagskraft gör det svårare att följa ärftligheten. David Olofsson känner bara till en släkting med Skelleftesjukan, en kusin som gick bort för några år sedan. Under sin sjukdomstid fick kusinen en levertransplantation, vilket var den första specifika behandlingen mot sjukdomen.
Utan någon behandling alls överlever människor ungefär tio år efter att de fått sina första symtom. I Sverige är medelåldern bland dem som insjuknar 58 år, men variationen är stor – allt från 22 till 84 år.
Det går att dela in patienterna i två grupper. Hos dem som insjuknar lite längre upp i åren uppstår en typ av amyloidfibriller som också påverkar hjärtat. I den gruppen ingår David Olofsson, som fyller 73 i sommar.
Hos den andra gruppen har fibrillerna en form som skonar hjärtat. Nackdelen är att besvären brukar komma tidigt i livet. Den typen av transtyretinamyloidos är den vanligaste i Portugal, men förekommer även i Sverige.
Började med pirrande känsla

Bild: Elin Berge
Joakim Gustafsson var 35 när han drabbades för två år sedan. Han är i likhet med David Olofsson en av försökspersonerna i studien av gensaxen Crispr/Cas9 mot Skelleftesjukan. Efter att ha varit vd för Umeås ishockeylag Björklöven hade han gett sig in i en ny bransch som vd för ett tjänsteföretag inom IT och telefoni. I hans fall var det tidigaste tecknet en pirrande känsla i ben och fötter. Efter några månader blev det värre.
– Ibland hade jag så ont att jag bara låg hemma och skrek, säger han när vi ses i företagets huvudkontor på Storgatan i centrala Umeå.
Joakim Gustafsson anade att det kunde vara Skelleftesjukan men det tog sin tid att få rätt diagnos. Smärtor och domningar kan uppstå av många skäl, och Skelleftesjukan är trots allt sällsynt även i norra Sverige där den är som mest utbredd.
Ett enkelt gentest räcker för att hitta anlagsbärare. I dag kan vem som helst köpa ett test på nätet som avslöjar mutationer kopplade till ärftlig transtyretinamyloidos.
Att ta reda på om mutationen orsakat några sjukliga förändringar är svårare. Patienter få lämna ett prov i form av en bit underhudsfett från magen. Personalen vid ett kliniskt laboratorium behandlar sedan provet med ett färgämne och kikar i ett mikroskop efter spår av amyloidfibriller.
Alla med sjukdomen har släktband
I hela världen finns över hundra kända mutationer som orsakar ärftliga former av transtyretinamyloidos. I Sverige beror 95 procent av alla sjukdomsfall på en enda mutation som funnits i mer än 400 år (Val30Met). Nina Norgren, bioinformatiker vid Umeå universitet, har skrivit en doktorsavhandling som slår fast att mutationen uppstod hos en individ med släktband till alla i dag levande människor med sjukdomen. Genom släktforskning i kyrkböcker och andra arkiv har hon spårat anlaget till troliga bärare inom sex familjer på 1600-talet i trakterna kring Burträsk i Västerbotten.
Behandlingar mot sjukdomens grundorsak har bara funnits i några decennier. Den första levertransplantationen till en patient med Skelleftesjukan genomfördes i Stockholm år 1990. Tanken var att den nya levern skulle tillverka transtyretin utan benägenhet att trassla ihop sig till skadliga fibriller. Totalt har ungefär 150 människor med Skelleftesjukan i Sverige fått en ny lever. Många har blivit hjälpta men i vissa fall går det dåligt, i synnerhet för äldre patienter.
Antalet transplantationer minskade kraftigt i samband med att mediciner mot Skelleftesjukan blev tillgängliga. Den första, tafamidis, godkändes i Europa år 2011. Den verkar genom att stabilisera transtyretin så att det inte trasslar ihop sig så lätt. Långtidsdata tyder på att medicinen förlänger livet hos patienter i ett tidigt skede av Skelleftesjukan. En nackdel är priset – cirka 1,2 miljoner kronor per patient och år.
Skenande kostnader för läkemedel
Det finns dock ett alternativ till mindre än en hundradel av den kostnaden. Diflunisal är ett äldre och numera avregistrerat inflammatoriskt läkemedel. Medicinen bromsar Skelleftesjukans förlopp, enligt en randomiserad studie med 130 patienter publicerad 2013. Läkare har tidigare skrivit ut diflunisal mot Skelleftesjukan på licens från Läkemedelsverket.
Nu är den möjligheten i stort sett borta. Orsaken är att ytterligare två mediciner har blivit godkända i Europa. Båda två är olika varianter av genterapi som slår ut arbetskopiorna (mrna) av den genetiska information cellerna behöver för att tillverka transtyretin. Lägre halter av felveckat protein i blodet minskar inlagringen av amyloidfibriller i kroppens organ, vilket bromsar sjukdomsförloppet.
Tyvärr är båda medicinerna extremt dyra. Det officiella priset ligger på över tre miljoner kronor per patient och år.
När dessa mediciner nu är registrerade ska de användas i stället för diflunisal, enligt Läkemedelsverkets regler. Därmed har kostnaderna för att behandla Skelleftesjukan skenat.

Bild: Elin Berge
Jonas Wixner, ansvarig för amyloidoscentrum vid Norrlands universitetssjukhus, kämpar för att det billigare alternativet diflunisal ska bli ett registrerat läkemedel, eller på annat sätt tillgängligt för patienter med Skelleftesjukan. Hittills utan framgång.
– Det är jättefrustrerande. Det finns inga pengar i diflunisal tyvärr, så ingen har velat ta tag i det här, säger han.
Samtidigt är han glad över att forskningen om Skelleftesjukan på senare år gjort så stora framsteg. När han började sin läkarbana fanns det inga specifika mediciner alls mot Skelleftesjukan. Nu finns flera olika behandlingsalternativ, både genterapier och läkemedel som stabiliserar transtyretin.
Joakim Gustafsson har fått både det stabiliserande läkemedlet tafamidis och den experimentella gensaxen.
– Ska man se någonting gott i det här så var det väl tur att man fick sjukan nu, och inte för tio år sedan, säger han.
Påverkar leverns produktion av transtyretin
Gensaxen är den första behandlingen som går ut på att permanent minska leverns tillverkning av transtyretin. Dagens genterapier som riktas mot cellernas arbetskopior av genen för transtyretin gör samma sak, men bara på kort sikt. De kräver intravenösa påfyllningar med några veckors mellanrum livet ut. Gensaxen är tänkt att lösa problemet en gång för alla.
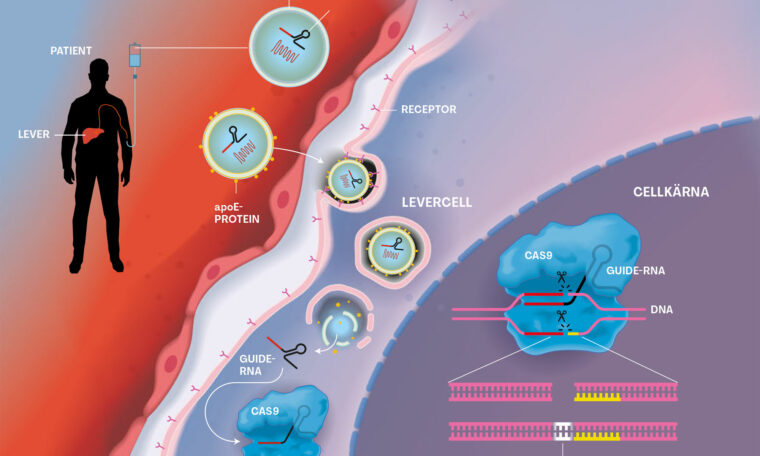
Gensaxen verkar i levern
– Vi har sett att mängden transtyretin i blodet efter en behandling minskar med omkring 90 procent. Det är förmodligen tillräckligt, säger Björn Pilebro.
Joakim Gustafsson fick sitt dropp med den experimentella behandlingen redan för ett halvår sedan. Det har inte varit någon mirakelkur. Senast i natt vaknade han med en så starkt brännande smärta i benen att han gick ut på altanen och kylde dem med snö.
– Folk tror att nu är det frid och fröjd. Men i min värld är det fortfarande nästan samma sak. Det känns skönt att kroppen har stoppat upp produktionen av transtyretin. Men det känns ju inte skönt att kroppen har hunnit bli så förstörd på så kort tid, säger han.
Han hoppas att behandlingen åtminstone bromsar förloppet. I bästa fall börjar skadorna läkas. När levern producerar mindre av det felveckade proteinet är det tänkbart att kroppen kan städa bort skadliga amyloidfibriller. Företaget Intellia, som utvecklat den experimentella behandlingen med Crispr/Cas9, lyfter fram den möjligheten. I så fall skulle patienter med Skelleftesjukan på sikt kunna bli bättre. Men än så länge är det spekulationer. Mycket forskning återstår när det gäller att behandla sjukdomar med gensaxen direkt i blodet.
Skelleftesjukan orsakas av en enda trasig gen
Det finns flera skäl till att det första kliniska försöket gäller just Skelleftesjukan. Sjukdomen är allvarlig. Dessutom beror den på en enda trasig gen, vilket är en förutsättning för framgångsrik genterapi. Och tidigare forskning visar att behandlingar som tystar genen bromsar sjukdomen. Det är alltså inte nödvändigt att ersätta den trasiga genen med en ny, vilket är komplicerat. Med ett extra tillskott av vitamin A klarar man sig bra med en utslagen gen för transtyretin.
Den inledande fas 1-studien som pågår i Umeå ska enligt planerna bli klar i mars 2025. Därefter behövs ytterligare prövningar för att visa om gensaxen i form av intravenöst dropp verkligen lindrar eller rent av botar Skelleftesjukan.
För David Olofsson har allt gått bra så här långt. De senaste blodproverna visar att halten av proteinet transtyretin har gått ner. Det är ett gott tecken. Men han är klar över att han är försöksperson i ett experiment.
– Om det här funkar så hinner jag ju kanske själv vara med på tåget så att säga. Men annars hjälper jag kanske någon annan framöver, säger David Olofsson.