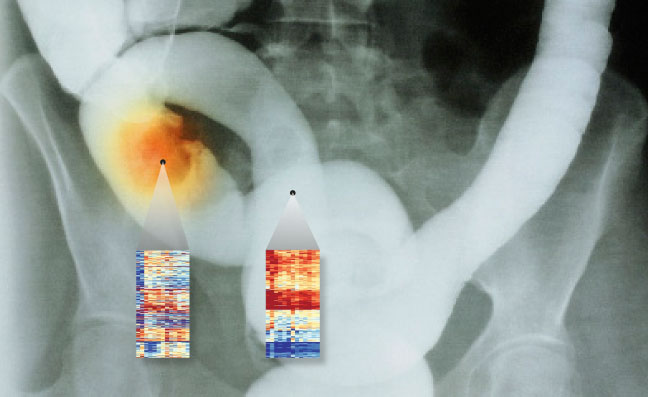
Lurar i tarmen. Cancer i tjocktarmen drabbar ungefär 4 000 svenskar varje år. Friskt och sjukt. Dna från normala tjocktarmceller (t.h.) har ett annat metyleringsmönster än dna från tumörceller (t.v.). Rött betyder mycket metylering, blått lite. Källa: Nature Genetics.
Bild: Science photo library
Cancer uppstår när celler tappar minnet
Förändringar i hur vår arvsmassa avläses i kroppens celler bidrar till att ge cancer. Tumörceller tycks helt enkelt förlora sin identitet.
Det här är en artikel från 2010.
Hur kommer det sig att vissa människor löper större risk för sjukdom än andra? En viktig del är våra gener, arvsmassan som mor och far har bidragit med. Olika små förändringar som antingen ärvs eller uppstår i befruktningsögonblicket sätter avtryck hos oss, och ibland kan sådana små skillnader bädda för sjukdom.
Men hur arvsmassans byggstenar är sammanfogade i dna-spiralen ger inte hela bilden. Det senaste decenniet har allt fler forskare börjat intressera sig för så kallade epigenetiska förändringar, som avgör hur arvsmassan läses av. Allt tyder nämligen på att sjukdomar inte bara beror på hur arvsmassan ser ut, utan också på hur den styrs. Det handlar dels om kemiska förändringar av själva dna-strängen, så kallade metyleringar, dels om hur arvsmassan förpackas i cellkärnan. Detta skiljer sig åt mellan olika människor och påverkas både av våra gener och av vår miljö.
Vår kropp är uppbyggd av mer än 250 olika celltyper. De har skapats genom att ett stadium följts av ett annat hela vägen från äggets befruktning till de färdiga celltyperna i fostret. Under varje utvecklingsstadium fästs så kallade epigenetiska minnen vid cellens arvsmassa. De begränsar successivt varje cells möjlighet att bilda olika celltyper. Epigenetiska minnen kan även uppstå hos vuxna individer, exempelvis när tarmslemhinnans celler hela tiden nybildas för att ersätta celler som nöts bort.
Vilka epigenetiska minnen som bildas beror på samspelet mellan cellen och mikromiljön i dess vävnad, exempelvis levern eller en muskel.
Fastän alla våra kroppsceller har identisk eller nära nog identisk arvsmassa, råder stora skillnader mellan vilka arvsanlag som är aktiva respektive inaktiva i olika slags celler. Det gör att en muskelcell har andra aktiva och inaktiva arvsanlag än de som finns i en levercell.
Det här gäller även stamceller, alltså de omogna celler som både kan förnya sig själva och utvecklas till exempelvis mogna nerv- eller hudceller. I slutänden handlar epigenetik alltså om mekanismer som bestämmer när, var och hur arvsanlagen aktiveras eller inaktiveras för att definiera en viss celltyp.
En liten del av arvsanlagen, mellan 1 och 2 procent, har alldeles särskilda epigenetiska egenskaper. De nedärvs med ett aktivt förtecken från vår mamma eller pappa, medan den andra förälderns kopia är inaktiv. Detta fenomen kallas genomisk prägling.
För att beteckna summan av alla epigenetiska minnen i arvsmassan används begreppet epigenom. Att det epigenomiska mönstret hos en viss person påverkas av miljön stod klart efter en spansk studie av enäggstvillingar. Medan sådana syskonpar i princip har identisk arvsmassa, visade det sig nu att deras epigenom skiljer sig åt markant. Det gäller både hur mycket metylerad själva dna-strängen är och hur arvsmassan packats samman i kromosomerna. Enäggstvillingarna i denna studie levde sina liv på var sitt håll. Därför är det sannolikt att de epigenetiska skillnaderna återspeglar miljö och livsstil.
Att det förhåller sig så är inte så konstigt, eftersom det är känt att miljöfarliga ämnen och diet påverkar hur mycket dna-strängen metyleras. Vi vet också att lågt intag av vitaminet folsyra, aminosyran metionin eller spårämnet selen minskar metyleringen. Även andra ämnen som arsenik, som kan finnas i dricksvatten, och aromatiska kolväten, som finns i bensin och cigarettrök, kan ge upphov till förändrad metylering.
Dessutom kan en viss individs känslighet för diet och miljöfarliga ämnen påverkas av ytterst små variationer i arvsmassan. Ett exempel är just genen bakom det enzym som spjälkar folsyra för att skapa de kemiska ämnen som behövs för att arvsmassan ska kunna metyleras. Där finns en variant som gör att kroppen tillverkar enzym med sämre funktion än normalt. Hos den som ärvt sådana genkopior från båda föräldrarna försämras metyleringen av arvsmassan oberoende av hur mycket folsyra hon eller han får i sig.
Samspelet mellan epigenetik, vår miljö och individuella genetiska variationer kan också öka risken för sjukdomar, särskilt om de förekommer tillsammans med vissa andra faktorer, exempelvis kroniska bakterie- och virusinfektioner. I princip har alla sjukdomar hos människan en epigenetisk komponent, direkt eller indirekt. Det kan exempelvis handla om att vissa gener stängts av. Om just de generna normalt ger upphov till proteiner som ser till att reparera dna när cellen delar sig, kan en avstängning leda till skador på arvsmassan.
Det mesta av vår kunskap om hur epigenetiken griper in i sjukdomar handlar för närvarande om cancer. Sjukdomen uppstår stegvis när genetiska och epigenetiska förändringar samverkar och leder till att en frisk cell samlar på sig egenskaper som gör att den börjar växa och dela sig ohämmat.
Studier har också visat att cancerceller kan omprogrammeras i provrör och bli till så kallade embryonala stamceller, som i sin tur kan ge upphov till mer eller mindre normala embryon. Eftersom själva arvsmassan är identisk i cancercellen och dess embryonala ”avkomma” visar sådana experiment hur oerhört viktiga epigenetiska förändringar är under cancerprocessen.
När det gäller förändringar som påverkar själva arvsmassan kan epigenetiken handla om att minskad metylering av dna aktiverar normalt inaktiva arvsanlag. Eller så kan ökad metylering tvärtom inaktivera redan aktiva arvsanlag, exempelvis gener som normalt motverkar tumörbildning. I ett fall har det till och med visat sig att inaktivering av en sådan gen, kallad p16ink, sker i två steg: först minskad och sedan ökad metylering.
Arvsmassans läsbarhet beror också på hur hårt eller löst dna-strängen är packad i kromosomen. I luckert packade områden är arvsmassan mer tillgänglig för avläsning, i mindre grad där den är tätt packad.
I vår forskning arbetar vi nu med vår upptäckt att kromosomerna faktiskt ”pratar” med varandra. Det innebär att när kromosomerna ligger i cellkärnan kan delar av olika kromosomer komma i direktkontakt och överföra epigenetisk information mellan varandra. Dessa nätverk inbegriper genomiskt präglade delar som verkar kommunicera med varandra bara om de har ärvts från modern (se rutan ovan). Intressant nog har det visat sig att om den genomiska präglingen förloras på ett ställe, så kan det orsaka rubbningar på många andra ställen i arvsmassan. Vi tror att detta slags förändringar i områden som styr cellens tillväxt bidrar till att celler omvandlas till cancerceller. I linje med detta har vi tidigare visat att cancerrisken ökar om viss genomisk prägling går förlorad.
En amerikansk forskargrupp ledd av Andrew Feinberg vid Johns Hopkins University School of Medicine visade förra året att cancerceller tappar sin celltypiska identitet, åtminstone om man ser till arvsmassans metyleringsmönster. Hos en grupp cancerpatienter jämförde forskarna celler från tumörer i tjocktarmen med friska tjocktarmsceller. Det visade sig då att arvsmassan i tjocktarmsceller som bildat tumörer är betydligt mindre metylerad än arvsmassan i friska celler. De upptäckte också att ett metyleringsmönster som är typiskt för en viss celltyp kan härmas av en tumörcell som ursprungligen kommer från en annan vävnad. I deras försök visade sig celler från tjocktarmstumörer mer likna friska leverceller än frisk tarmvävnad.
I januari i år presenterade Andrew Feinberg en idé som skulle kunna förklara varför det finns epigenetiska förändringar: en ärftlig benägenhet att snabbt kunna reagera på en föränderlig miljö. En nedärvd ökad förmåga att reagera på ny miljö kan ha varit en stor fördel i mänsklighetens långa historia och kunnat resultera i fler barn. Nu, när vi lever betydligt längre och kanske också utsätts för mer miljöpåverkan, kan dock priset för denna förändringsförmåga innebära en ökad risk för cancer. I artikelns slutmening funderar forskarna på om just upprepade, små variationer i en cells mikromiljö kan spela roll, exempelvis om en vävnad vid upprepade tillfällen utsätts för cancerframkallande ämnen.
Vi vet inte exakt när de epigenetiska förändringarna sker i förvandlingen från en frisk cell till en cancercell. En populär hypotes är att all slags cancer uppstår till följd av epigenetiska rubbningar i stamceller. Dessa rubbningar bäddar i sin tur för genetiska förändringar och problem när cellen ska mogna. Om denna hypotes visar sig hålla kan många cancerformer, kanske alla, ha samma ursprung.
Trots de stora framsteg som skett inom epigenetiken det senaste decenniet är klivet till förbättrad sjukvård fortfarande långt. Epigenetiska tillstånd bakom ett visst symtom kan se mycket olika ut hos olika individer. Arvsmassan skiljer sig som mest med 0,8 procent mellan två människor, men för epigenomet är motsvarande andel drygt 10 procent. Av liknande skäl kan den epigenetiska basen för cancer bli svår att komma åt. Om man tänker sig att cancer beror på epigenetisk instabilitet hos sjukliga stamceller räcker det inte med läkemedel som motverkar dessa förändringar. Även om några celler effektivt slås ut, kan nya celler komma fram som har andra kombinationer av epigenetiska rubbningar men som ger liknande, snabbväxande egenskaper. Å andra sidan kan förbättrade diagnoser, som identifierar de drabbade stamcellerna, ge möjlighet att sätta in effektiv behandling – innan epigenomet hamnar i det kaos som finns hos cancerceller.
En annan möjlig följd av epigenetisk forskning finns inom så kallad regenerativ medicin, där man från stamceller vill återskapa frisk vävnad som förlorats vid skada eller sjukdom. Man kan tänka sig att det går att ta differentierade celler från en patient och sedan programmera om dem till ett epigenetiskt mönster som är typiskt för stamceller. I nästa steg skulle de nyskapade stamcellerna kunna omvandlas till en ny, differentierad celltyp med dess typiska epigenetiska mönster. Celler framtagna på detta vis skulle vara kroppsegna och anpassade till personens immunsystem, något som gör att de går lätt att transplantera. Men vi är ännu inte där, eftersom det är oklart hur effektiv den epigenetiska omprogrammeringen är. Risken finns att misstag i denna process skulle kunna få ödesdigra konsekvenser för patienten, exempelvis genom att bädda för cancer.
Autism och schizofreni kan ha epigenetiska orsaker
Medan cancer är en urvalsprocess mot ett alltmer kaotiskt epigenom, gäller detta inte för sjukdomar där effekterna av epigenetiska rubbningar är mer subtila. Det har visats att ett område med genomiskt präglade gener på kromosom 15 är kopplat till autism. Denna sjukdom är också kopplad till inaktivering av en särskild gen, vars proteinprodukt specifikt binder till metylerat dna och ser till att denna och intilliggande regioner aktiveras.
Schizofreni har kunnat kopplas till ett protein som krävs för att nervcellernas kopplingar ska kunna förändras. I försök på möss visar det sig att behandling med valproinsyra, ett ämne som annars används mot epilepsi, aktiverar genen bakom proteinet. Det antyder att sjukdomen i vissa fall skulle kunna botas. Det är också intressant att valproinsyra har använts för behandling av epilepsi långt innan man visste att den förhindrar epigenetisk inaktivering.
Föräldrarnas gener turas om i dina celler
De flesta av de så kallade genomiskt präglade arvsanlagen (där antingen moderns eller faderns genkopia är aktiv) styr cellens tillväxtpotential. Aktiva arvsanlag från pappan ökar fostrets tillväxt, något som aktiva arvsanlag från mamman motverkar.
En huvudteori är att våra däggdjursförfäder var promiskuösa till den grad att syskonen i en kull kunde ha olika pappor, medan mamman naturligtvis var densamma. Då skulle pappornas arvsmassa konkurrera med varandra under utvecklingen, medan det låg i mammans intresse att bromsa denna effekt. Följden är att flera gener som motverkar tumörbildning är aktiva bara om de kommer från mamman. Eftersom det till skillnad från icke-präglade arvsanlag bara krävs ett epigenetiskt inaktiveringssteg – pappans arvsanlag har ju redan nedärvts inaktiverat – innebär det att risken för cancer ökar.
En annan konsekvens av studier på präglade gener är att vi nu vet att visst beteende styrs epigenetiskt. Exempelvis har det visats att ett arvsanlag som är aktivt bara från pappan styr modersinstinkten i dotterns beteende. Kanske har evolutionen selekterat fram ett beteende där den epigenetiska varianten hos vissa av pappans arvsanlag ser till att hans gener hos barnbarnen tas väl om hand av dottern.