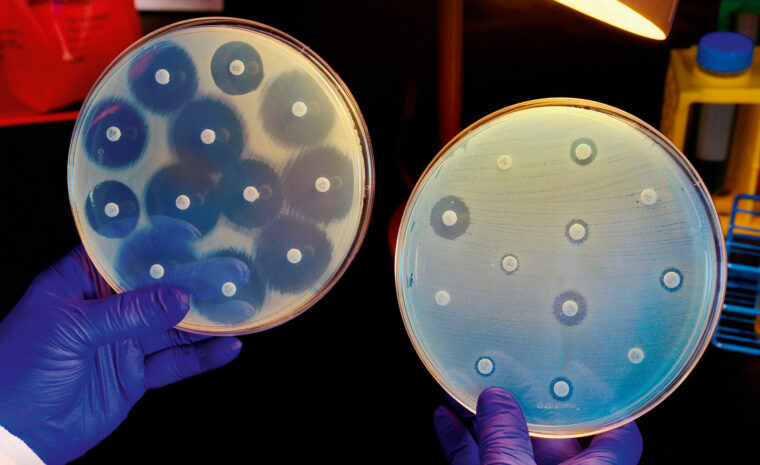
När antibiotika slutar fungera för att bakterierna utvecklat motståndskraft – resistens – står många liv på spel.
Bild: Getty images
Antibiotikaresistenta bakterier sätter liv på spel
Bakterier som är resistenta mot antibiotika är ett allvarligt och växande hot mot både människors och djurs hälsa. Inom EU avlider 33 000 människor varje år av sjukdomar orsakade av resistenta bakterier.
Det här är en text från 2020.
Den kapprustning som pågår mellan oss och de mikrober som skadar oss är lika gammal som vårt liv på jorden. Men den period som människor har haft tillgång till verkningsfulla, bakteriedödande läkemedel är inte ens 100 år gammal.
Dan Andersson, professor vid Institutionen för biokemi och mikrobiologi vid Uppsala universitet, samt föreståndare för Uppsala Antibiotic Center, beskriver jordens liv i form av ett träd.
– Om man tänker sig ett fylogenetiskt träd som beskriver alla olika arter och hur de har utvecklats ifrån varandra, ryms vi som syns – människor, elefanter, plattmaskar och bananflugor – på ett enda litet löv. Resten av trädet är mikroskopiska eubakterier och arkéer, säger han.
Det är också, säger han, en missuppfattning att alla bakterier är ”små, runda saker”.
– Fylogenetiskt är bakterier mycket olika. En gul stafylokock är lika olik en E.coli-bakterie som en människa är jämfört med en jästcell, säger han och fortsätter:
– Det är ju fantastiskt att vi ändå har lyckats hitta så många preparat som faktiskt fungerar.
Men antibiotikas förmåga att döda eller hindra bakterier från att växa driver dem också att utveckla motståndskraft – resistens. Ett sätt att motverka detta är att ta fram nya antibiotika. Men bortsett från att det är dyrt och komplicerat, kommer bakterier att utveckla motståndskraft även mot nya antibiotika. För att kunna fortsätta använda befintliga antibiotika letar forskare därför efter metoder som gör att de ska kunna användas på ett smartare sätt. Det kan handla om snabbare och mer precis diagnostik, vaccination eller hjälpsubstanser som stärker effekten av antibiotika.
Snabbare och mer precis diagnostik
Att diagnostisera vilket antibiotikum en bakterie är känslig för är viktigt, eftersom det minskar risken för att läkaren skriver ut antibiotika som inte dödar, utan som i stället bidrar till mer resistens. I dag sker diagnostik genom att man på laboratoriet stryker den bakterie som ska analyseras på en agarplatta. På ytan placeras sedan små papperslappar doppade i olika antibiotika. Efter 24–48 timmar går det att se runt vilka lappar som bakterien inte har vuxit, vilket betyder att det är dessa antibiotika som bakterien är känslig för.
Bild: Getty images
Just nu talas det mycket om en alternativ metod, så kallad helgenomsekvensering, som innebär att man sekvenserar bakteriernas hela arvsmassa. Det är ett sätt att ta reda på om en viss bakterie har skaffat sig någon av de resistensgener som man i dag känner till, gener som visar att en bakterie inte längre kan oskadliggöras med en viss typ av antibiotika.
Men Dan Andersson är tveksam till denna metod. Ett skäl är att det i dag tar lång tid. Och även om det skulle gå att snabba på analysen är det inte säkert att en hittad resistensgen uttrycks som resistensförmåga i den aktuella bakterien, eller åtminstone inte i tillräckligt hög grad.
– Och omvänt – om man inte hittar någon av de många resistensgener vi känner till, kan bakterien kanske ändå ha skaffat sig motståndskraft på något nytt vis. Men helgenomsekvensering har blivit något av ett mantra, säger han.
Dan Andersson förespråkar i stället diagnostik som baseras på bakteriens beteende, liknande metoden med de klassiska agarplattorna. Han berättar om en förfinad plattmetod som har utvecklats av Gunnar Kahlmeter, chef för mikrobiologiska enheten vid Växjö lasarett. I stället för att vänta ett dygn eller två, till dess att bakterierna blivit så många att de syns för blotta ögat, använder man mikroskopi för att se var på plattan det växer eller inte.
– Då går resultatet att se redan efter 4–6 timmar, beroende på bakterieart, säger Dan Andersson.
Ett annat projekt som också analyserar bakteriers beteende drivs av Johan Elf, professor vid Institutionen för cell- och molekylärbiologi vid Uppsala universitet. Här analyserar forskarna bakterier på ett slags chip, i smala vätskefyllda kanaler där bakterierna ligger på kö. I kanalerna kan man spruta in olika slags antibiotika. Chippet fotograferas var fjärde sekund under mikroskop och det går då snabbt att se i vilka kanaler som bakterierna slutar växa. Där de inte växer, där fungerar antibiotikan. När forskarna testade prover med bakterier från 49 patienter med urinvägsinfektion fick de inom tio minuter svar på om de var känsliga mot ett visst slags antibiotika.
Ett annat sätt att bedöma bakteriers beteende är att mäta de ”vibrationer” som uppstår när bakterier äter och växer till. I det fallet är det stillhet som indikerar att de har dukat under av en viss form av antibiotika.
– När det gäller den praktiska användningen för en läkare som har en patient framför sig är det mest relevant att snabbt få reda på om en viss bakterie är känslig eller inte. Då kan denna typ av diagnosmetoder göra att läkaren kan skicka hem patienten och säga att ”jag skriver ut något i eftermiddag som funkar mot just din bakterie”, säger Dan Andersson.
Avväpna bakterierna
Tidsaspekten är viktig när det gäller infektioner, eftersom det finns stora skillnader i både hur snabb och hur allvarlig en infektion är. I ena änden av skalan återfinns bakterier som ger mildare sjukdom, där det inte är så brådskande med behandling, som vid urinvägsinfektion eller klamydia. I andra änden handlar det om timmar innan den som drabbas är död, vilket kan ske vid till exempel sepsis, en allvarlig och organdrabbande infektion. (Sepsis kallas ofta lite slarvigt blodförgiftning, trots att bara 30 procent av fallen beror på bakterier i blodet.)
När förloppet är långsamt och infektionen mindre allvarlig kan det gå att ta fram läkemedel som inte dödar bakterierna, men som hindrar dem från att orsaka sjukdom, att helt enkelt avväpna dem.
Fredrik Almqvist, professor i kemi vid Umeå universitet, har forskat på just sådana metoder.
– Vid urinvägsinfektion skulle man kunna tänka sig att hitta sätt att avväpna bakterierna, genom att ta bort deras sjukdomsframkallande förmåga, så att kroppen själv kan hantera situationen, säger han.

Bild: Mary Evans Picture Library
Så blir bakterier resistenta
Antibiotika kallas läkemedel som dödar bakterier. Mest känt är penicillin, som upptäcktes av Alexander Fleming år 1928. Utöver att bota sjukdomar har antibiotika möjliggjort en stor del av dagens sjukvård. Att få en ny höftled eller att behandlas med cellgifter vid cancer är bara möjligt när det finns fungerande antibiotika som kan förhindra allvarliga infektioner.
En vanlig missuppfattning är att antibiotikaresistens betyder att en person blir resistent mot antibiotika, men resistens är en egenskap hos bakterien.
Ett sätt är att hindra bakterierna att fästa till slemhinnan vid urinvägsinfektion. För att fastna behöver de utveckla ett slags hårliknande strukturer, pili. När denna process, i försök, hindrades med hjälp av små molekyler förblev bakterierna ”skalliga” och lättare att komma åt. På liknande vis har bakterier lurats att binda till en designad molekyl, i stället för till kolhydrater på slemhinnans yta. Då får de inte fäste utan kan kissas ut. Amerikanska forskare har utvecklat ett sådant läkemedel mot just urinvägsinfektion, som nu testas.
Bättre effekt av antibiotika
Att förstärka befintlig antibiotikas effekt med en tillsats är en annan väg för att kunna behålla och använda läkemedel längre. Redan i dag används sådana läkemedel ihop med penicillin. Här är anledningen att resistenta bakterier har lärt sig att göra enzymet beta-laktamas, som förhindrar penicillinets effekt. Om bakteriens tillverkning av detta enzym kan stoppas med hjälp av ett hämmande läkemedel fungerar penicillin igen.
I dagsläget är Fredrik Almqvists forskning inriktad mot tuberkulos, som årligen dödar 1,5 miljoner människor världen över. Sjukdomen kräver antibiotikabehandling i minst ett halvår, och många patienter slutar ta sin medicin i förtid, trots att de har bakterier kvar i kroppen. Det ökar risken för resistens, trots att man behandlar med flera antibiotika samtidigt.
I kroppen bildar bakterien som orsakar tuberkulos, Mycobacterium tuberculosis, en mer robust form som är svår att komma åt med antibiotika. I laboratoriet går detta att efterlikna med att den bildar så kallad biofilm, en ogenomtränglig bakteriemassa. Ihop med Christina Stallings vid Washington university i St. Louis studerar Fredrik Almqvist molekyler som motverkar detta. De har hittat en molekyl, kallad C10, som har visat sig ha effekt. Om den kombineras med antibiotika behövs bara en bråkdel av antibiotikadosen jämfört med normalt och bakterierna har heller inte blivit resistenta. Molekylen har dessutom visat sig kunna få resistenta bakterier att tappa den förmågan, något som aldrig har visats förr. C10 har hittills bara provats i laboratoriet, så det är långt kvar till ett eventuellt läkemedel.
– Men nu vet vi i alla fall vilket slags molekyl som kan stärka antibiotikas effekt, och dessutom motverka och reversera resistens, säger Fredrik Almqvist.
Det finns ytterligare en poäng med att ta fram antibiotika-stärkande läkemedel. Ett problem i dag är att det i floderna, nedströms vissa läkemedelsfabriker har läckt ut antibiotika i flodvattnet, som gör bakterier runt om i miljön resistenta.
– En stor fördel med substanser som förstärker antibiotikas effekt, men som inte i sig är resistensdrivande, är att de inte kommer att ge resistensutveckling vid tillverkningen, säger Fredrik Almqvist.
I andra änden av Sverige, vid Lunds universitet, arbetar Anders P. Håkansson, professor i experimentell infektionsmedicin, med medel som förstärker antibiotikas effekt. Här handlar det om ett protein kallat Hamlet, som går att utvinna ur mänsklig bröstmjölk. Proteinet upptäckte han när han var doktorand i Lundaforskaren Catharina Svanborgs grupp, men då var det dess cancerhämmande effekter man studerade. Det har dock även effekt mot bakterier. I en studie nyligen publicerad i Journal of Biological Chemistry beskriver forskarna att proteinet har en bakteriedödande effekt mot så kallade pneumokocker. Men det har alltså även visat sig kunna förstärka effekten av befintliga antibiotika.
Förkortningen MRSA står för meticillin-resistenta stafylokock aureus. Dessa bakterier orsakar 8 miljoner infektioner i USA varje år, i Sverige cirka 3 500. Anders P. Håkanssons forskargrupp har visat att Hamlet har effekt mot dessa svårhanterliga bakterier som har utvecklat resistens.
– Hamlet dödar inte MRSA-bakterier, men gör att de återigen blir känsliga mot meticillin. Vi har också sett att det fungerar mot resistenta streptokocker och andra bakteriearter, säger han.
Anders P. Håkansson och hans team arbetar nu ihop med ett företag för att testa proteinet i en så kallad fas-II-studie, där man ska prova dess effekt på en mindre grupp patienter.
Redan innan antibiotika upptäcktes försökte forskare ta fram sätt för att kunna häva svåra bakterieinfektioner. En metod, så kallad fagterapi, innebär att man infekterar bakterierna med speciella virus – bakteriofager – som dödar bakterierna. Forskningen avstannade på många håll efter att antibiotikan hade upptäckts men fortsatte i Östeuropa, något som F&F skrev utförligt om i nr 8, 2014. Förra våren kom en fallstudie i tidskriften Nature Medicine som visade att just fagterapi fungerat för en person med lungsjukdomen cystisk fibros, som vid dubbelsidig lungtransplantation råkat bli infekterad med bakterien Mycobacterium abscessus. När den 15-åriga patienten fick en cocktail bestående av tre olika slags fager gick den svåra infektionen att häva.
– Detta är det första fall jag har sett där det använts med gott resultat och visar att det kan fungera, säger Anders P. Håkansson.
Vaccination mot bakterieinfektioner
Bakterier av arten Streptococcus pneumoniae, pneumokocker, orsakar årligen 1,6 miljoner dödsfall i sjukdomar som lunginflammation, sepsis och hjärnhinneinflammation. I Sverige rapporterades år 2018 drygt 1 400 fall av allvarlig pneumokockinfektion. Bakterierna finns som en del av normalfloran i näsan hos omkring 30 procent av alla friska, svenska barn. Normalt orsakar de inga problem, men äldre personer med någon underliggande sjukdom som sätter ner immunförsvaret, till exempel cancer, har en ökad risk för att få allvarliga pneumokockinfektioner. Bakterierna kan vara av åtminstone 97 olika varianter, så kallade serotyper. Sedan 2010 finns ett vaccin för barn som skyddar mot 10 till 13 varianter. Birgitta Henriques Normark, professor i klinisk mikrobiologi med inriktning mot klinisk bakteriologi vid Karolinska institutet, arbetar med att ta fram ett nytt vaccin mot pneumokockinfektioner.
– Andelen barn som bär på pneumokocker i dag är ungefär lika hög som innan vaccinationsprogrammet, men nu är 95 procent av bakterierna sådana som inte ingår i vaccinerna. Och över 70 procent av de allvarliga pneumokockinfektionerna hos äldre vuxna orsakas nu av icke-vaccintyper, säger hon.
Vacciner skyddar mot sjukdom genom att kroppen skapar ett immunologiskt minne. Vid vaccination tillförs ett så kallat antigen, i just det här fallet är det delar från bakteriens hölje. När immunförsvaret träffar på antigenet stimuleras de så kallade B-cellerna som har till uppgift att tillverka antikroppar. B-cellerna lär sig hur den angripande bakterien ser ut och vid nästa möte kan de snabbt dra igång produktionen av antikroppar. Dessa fäster vid smittämnet och pekar ut en invaderande bakterie för de celler i immunförsvaret som ska döda inkräktare.
Birgitta Henriques Normarks forskargrupp har funnit att pneumokocker knoppar av små blåsor, vesiklar. I dessa, 50–250 nanometer små blåsor, finns en rad olika proteiner som är specifika för bakterien. Hennes forskargrupp studerar nu om något av de protein som de har renat fram ur vesiklarna kan ge skydd mot pneumokockinfektion, och Birgitta Henriques Normark tror att ett nytt vaccin ligger tio till femton år fram i tiden.
– Vi tror att detta kan vara en framkomlig väg för att skapa ett nytt och mer effektivt vaccin.
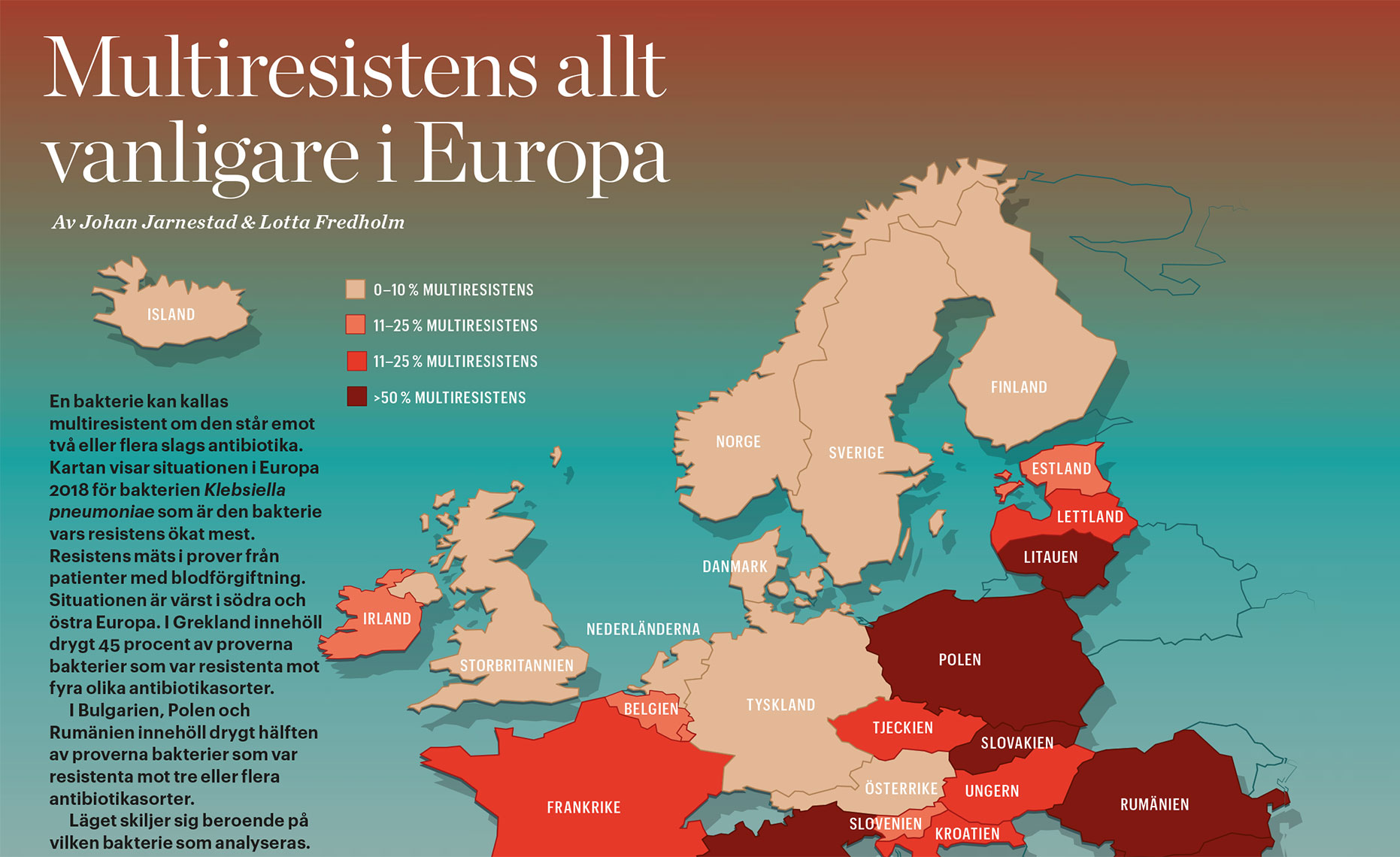
Multiresistens allt vanligare i Europa
Antikroppar som läkemedel
Vaccination är alltså ett sätt att skapa immunitet för att undvika att människor insjuknar i en viss sjukdom och det är de antikroppar som B-cellerna bildar som ger skyddet. Men det går även att använda antikroppar som läkemedel för den som redan har blivit sjuk. På det spåret arbetar Pontus Nordenfelt, docent i infektionsbiologi vid Lunds universitet. Han leder en av fem forskargrupper som ingår i ett projekt kallat EpIgG, som ska utläses ”Epitop IgG”. Epitop är den del av ett smittämne som en viss antikropp känner igen, medan IgG står för immunoglubulin G, den klass av antikroppar som i normala fall är mest förekommande i blodet. Redan under tidigt 1900-tal, innan antibiotikan upptäcktes, användes antikroppar som läkemedel.
– Då tog man serum från någon som tillfrisknat efter en sjukdom eftersom man misstänkte att det fanns något med skyddande effekt där, och gav det till en sjuk person, säger Pontus Nordenfelt.
Om du vill läsa mer om antibiotika
- Hur tillverkning av läkemedel bidrar till att öka resistens, F&F nr 6/2016.
- Nätapotek bäddar för supergonnoré, ur F&F nr 7/2018
- Svensk läkare saboterar kamp mot könssjukdom, ur F&F nr 8/2018
- Gonorréläkaren struntade i smittskyddslagen – får kritik
Målet med hans projekt är att kunna ta fram de gener som en effektiv B-cell har och som kodar för en viss antikropp. I förlängningen skulle skyddande antikroppar då kunna ges direkt vid sjukdom där antibiotika inte fungerar, som vid sepsis.
– Sepsis kan beskrivas som att en atombomb exploderar i kroppen, och i allvarliga fall kan det handla om att ett organ per timme slås ut. Bakterierna orsakar en överreaktion från kroppens sida, men det är inte helt klarlagt hur det går till, säger Pontus Nordenfelt.
Sepsis är ett stort problem och drabbar 40 000 svenskar varje år, varav 6 000 avlider. I dag ger man antikroppar intravenöst när inte antibiotika fungerar, men problemet är att dessa hämtas från olika personer och inte är av en definierad typ. Det gör att behandlingen fungerar bra ibland, och inte alls, i andra fall.
– Min dröm är att vi ska kunna ta fram en väl karakteriserad antikropps-mix som kan fungera som ett vapen mot sepsis för läkarna att ta till på akuten, säger Pontus Nordenfelt.
Hans arbete innebär att väldigt tydligt definiera var och hur antikroppar binder till olika mål-epitoper och vad olika slags bindning ger för resultat. En upptäckt är att bakterier har molekyler som gör att de kan ”vända på” antikroppar. Resultatet blir då att dessa inte fungerar. Då kan bakterierna klara sig undan immunsystemet, vilket i förlängningen skulle kunna öka risken för infektion.
– I blod finns så mycket antikroppar att det inte spelar roll om några vänds, men i saliv och på slemhinnor förekommer de i mindre utsträckning och här fungerade bakteriernas strategi, säger han.
Tillsammans med flera EpIgG-kollegor, bland andra Johan Malmström, har han också nyligen kunnat beskriva hur antikroppar beter sig i kontakt med en viss streptokock-bakterie, något som de 2019 presenterade i Nature Communications.
– När vi vet hur en bra antikropp binder till en epitop i blodet, kan man tänka sig att skapa en peptid som härmar den bindningen. Peptider är både lättare och billigare att ta fram än antikroppar, säger han.
Forskargruppen håller nu på att skriva ihop i en vetenskaplig artikel och har också en pågående patentansökan. Och Pontus Nordenfelt är i grunden optimistisk om kampen mot resistens.
–Om vi utgår från att antibiotika kommer att försvinna så sker det inte momentant, utan vi har lite tid på oss. Jag tror också att antikroppsspåret är absolut rätt och att det kan bli ett komplement till eller i vissa fall ersätta antibiotika, säger han.

Kunskap baserad på vetenskap
Prenumerera på Forskning & Framsteg!
Inlogg på fof.se • Tidning • Arkiv med tidigare nummer