Bild: Neil Webb / The Ispot
Rätt sätt att genförändra människor
I vilken utsträckning kan och bör vi ändra gener för att förbättra hälsa och förebygga sjukdomar? Ska ärftliga förändringar vara tillåtna och vem bestämmer vad som är sjukt? Tekniken att skräddarsy vår arvsmassa utvecklas snabbt – och nu måste etikfrågorna lyftas fram.
Uppdatering: Sedan den här texten skrevs hävdar den kinesiske forskaren He Jianku att det för första gången har fötts barn med genredigerad arvsmassa. He Jiankui säger att han har lett ett projekt där genredigering har använts för att skapa HIV-resistens i mänskliga embryon. Embryona ska ha använts till graviditeter och hittills har två tvillingar fötts, varav den ena hade den avsedda genetiska förändringen. Det är oklart om genredigeringen har haft andra effekter på barnet. Eftersom förändringen skedde i embryot kommer den att gå i arv till kommande generationer. Ingreppet ska ha skett eftersom pappan var bärare till HIV och en infektion av barnet ville undvikas. Försöken har skapat stor uppmärksamhet eftersom de går emot både kinesiska och internationella regler. Experimenten har inte föregåtts av någon diskussion och det finns många frågetecken kring omständigheterna. En stor del av forskarvärlden är mycket kritisk. Beskedet understryker hur snabbt tekniken utvecklas och behovet av debatt och regler om och när vi ska tillåta användning genredigerade embryon för graviditet.
En tidig morgon i början av december 2017 satt jag på tåget till Stockholm. Medan skog, åkrar och samhällen for förbi utanför fönstret vandrade tankarna. Jag funderade på mina barns egenskaper och det genetiska lotteri som utgör grunden för dem. Skulle jag och min sambo ha valt att ändra några gener om vi hade kunnat, och om vi visste vad effekten skulle bli? Kommer det att bli ett verkligt scenario i framtiden?
Just den här morgonen var jag på väg till ett stort möte med Statens medicin-etiska råd. Jag skulle presentera den senaste utvecklingen inom genteknik, och tillsammans med genetiker, läkare, politiker, jurister, etikexperter och andra kunniga personer gå igenom de snabba vetenskapliga framsteg som gör att vi kan analysera vår arvsmassa, och förutsäga allt mer om våra egenskaper och sjukdomar – och även förändra våra egna gener.
Framför allt skulle vi diskutera möjligheten att skapa genetiskt modifierade människor. Vilken användning av genteknik kan vara acceptabel, och vilken är det inte? Hur ser dagens lagar, regler och internationella överenskommelser ut, och hur ska de anpassas till den snabba utvecklingen?
Intresset för gener och genteknik ökar. Mina barn och jag har testat experiment för genmodifiering av bakterier som går att beställa på nätet, och det finns en gryende rörelse av hobbygenetiker som gör experiment på egen hand. Många – även jag – använder genetiska tester för släktforskning och analys av egenskaper och hälsa. Jag har fått veta hur mycket neandertalare jag är, att jag antagligen inte kommer att bli skallig och att jag inte har några kända anlag för ärftliga sjukdomar. Jag är fascinerad av att se hur inflätad jag är i Europas historia och folkvandringar, samtidigt som jag är lite avundsjuk på min sambo, som genom sin släkt från Madagaskar också har nära kopplingar till både Afrika och Asien.
Resultat från hälsotest för hemmabruk kan vara värdefulla, men de är också svårtolkade och kan ge upphov till onödig oro. I vården ökar användningen av avancerade genetiska tester för diagnostik och för att vägleda behandling. Det nystartade projektet Genomic medicine Sweden ska samordna och vidareutveckla genetisk diagnostik i Sverige.
I takt med att kunskapen ökar om hur våra gener påverkar hälsan har en diskussion vuxit fram om i vilken utsträckning vi kan och bör ändra gener för att förbättra vår hälsa. En avgörande faktor är om den genetiska förändringen blir ärftlig eller inte.
Användning av genetiskt modifierade spermier, ägg eller embryon för en graviditet skulle leda till att genförändringen sedan går i arv till framtida generationer. I dag är det förbjudet enligt lagen om genetisk integritet i Sverige. Det är också förbjudet enligt Oviedo-konventionen från 1997, som 35 länder har skrivit på, däribland Sverige. Men att göra genetiska förändringar som inte går i arv är däremot inte olagligt, men regleringen är oklar.
Grunden för den accelererande utvecklingen är den revolutionerande teknik som slog igenom 2013. Det handlar om metoder som baseras på ett system av enzymer som kallas för CRISPR-Cas. Särskilt använt är Cas9-enzymet, som kan användas för mycket specifik och precis förändring av generna. Vi kallar det numera för genredigering.
CRISPR-Cas förekommer naturligt som immunsystem hos mikroorganismer, något som jag har studerat under många år. Jag och mina kollegor hade på känn att systemet skulle kunna användas som genetiskt verktyg, men ingen hade kunnat förutse vilket enormt genomslag det skulle få. I dag är Cas9 ett rutinverktyg i tusentals laboratorier världen över. Det har varit fascinerande att delta i en så dramatisk utveckling, som inkluderar så många områden inom biologi, bioteknik och medicin, och där det varje dag publiceras ett tjugotal nya vetenskapliga studier.
Många sjukdomar påverkas av våra gener. Blödarsjuka, cystisk fibros och muskeldystrofi beror helt och hållet på genetiska förändringar, som antingen har ärvts eller uppstått hos den drabbade individen. I andra fall kan genvarianter bidra till en ökad risk att få sjukdomar där också miljöfaktorer och livsstil påverkar, som cancer och hjärt-kärlsjukdomar.
Möjligheten att påverka våra gener för att behandla sjukdomar, så kallad genterapi, har utforskats i årtionden. Nya behandlingar baserade på CRISPR-Cas är fortfarande under utveckling. Men det finns ett fåtal genterapier som redan har godkänts, som använder andra tekniker. Det kan handla om behandlingar där celler samlas in från patienten, förändras genetiskt och sedan återförs till patienten, till exempel för att behandla svår brist i immunsystemet. I andra fall används viruspartiklar för att leverera nytt genetiskt material till patientens celler. Det kan verka märkligt att använda virus för en behandling, men faktum är att det är en lösning på ett stort problem: Hur ska den förändrade genvarianten kunna föras in i tillräckligt många celler för att behandlingen ska ha effekt? En vuxen människa består av ungefär fyrtio biljoner celler! Dna-molekyler och proteiner som injiceras direkt i blodet har svårt att ta sig in i celler. Men virus har en enastående förmåga som har utvecklats i miljarder år för att föra in dna- eller rna-molekyler i olika typer av celler. Om vi skapar viruspartiklar som bär gener för Cas9 i stället för virusets egna gener, så kan vi utnyttja virusets egenskaper för att påverka just de egenskaper vi önskar i stora mängder av celler. Ett problem är att vårt immunsystem kan reagera starkt på själva viruspartiklarna, oavsett deras genetiska innehåll. I test av genterapi i USA 1999 avled en försöksperson, Jesse Gelsinger, på grund av att hans immunförsvar reagerade så kraftigt på det virus som användes. Testet kritiserades på goda grunder och dödsfallet bidrog till att utvecklingen av genterapi avstannade i många år. I dag används främst andra typer av virus, som immunsystemet reagerar mindre starkt på.
De problem som är kopplade till att använda virus kan undvikas med alternativa metoder. Nyligen publicerades till exempel en studie där guldnanopartiklar med Cas9 injicerades i hjärnan på möss. Behandlingen ledde till en lokal genförändring av nervceller och lindrade effekterna av en sjukdom som hos människor leder till utvecklingsstörning och kan bidra till autism.
En annan sak som är mycket viktig vid utveckling av genterapi är att minimera risken för att generna ändras på fel sätt, eftersom det i värsta fall kan leda till cancer eller andra sjukdomar. Nya sätt att leverera Cas9 och nya versioner av enzymet ger förbättrad precision på den punkten.
Flera behandlingar baserade på genredigering genomgår nu klinisk prövning. Det innebär att de testas på människor, för att undersöka om behandlingarna är säkra och effektiva. I Kina pågår tester där cancerpatienter fått sina immunceller genetiskt modifierade med Cas9, så att de trimmas att angripa tumörcellerna – en vidareutveckling av de upptäckter som belönades med årets Nobelpris i medicin. I Europa har test av en behandling för blodbristsjukdom fått grönt ljus. Det finns även andra verktyg än Cas9 för genredigering, som testas för behandling av hiv-infektion och för en svår ämnesomsättningsstörning. I enstaka fall har genredigering gjorts på patienter i kritiskt tillstånd trots att de inte ingått i någon studie. År 2015 användes genredigerade immunceller för att framgångsrikt behandla leukemi hos en ettårig flicka och 2017 användes modifierade stamceller för att återskapa nästan hela huden på en sjuårig pojke med en svår ärftlig sjukdom.
Många forskare och företag runt om i världen, inklusive kollegor till mig här på Uppsala universitet, utvecklar nu metoder för att behandla olika sjukdomar med genredigering. Optimismen är stor, men användningen av de genterapier som redan finns manar till eftertanke. Som exempel har vi Glybera, den första genterapin som godkändes i Europa. Läkemedlet behandlar en oförmåga att bryta ner vissa typer av fett, som då i stället ansamlas i blodet och andra delar av kroppen. Behandlingen innebär att patienten får en korrekt version av sin inaktiva gen via ett virus, som injiceras. Läkemedlet godkändes 2012 och har sedan dess använts på endast en patient i hela världen, och då först efter en utdragen förhandling med patientens försäkringsbolag. 2017 drogs läkemedlet in på grund av bristande användning. Engångsbehandlingen blev världens dyraste läkemedel med ett pris på flera miljoner kronor.
Även i andra fall kommer genterapi sannolikt att bli mycket kostsam. Hur ska patientens lidande och kostnaden för ofta livslång vård balanseras mot höga kostnader för läkemedel? Kommer någon att vilja satsa på att ta fram genterapi mot svåra och ovanliga sjukdomar, om utvecklingskostnaderna inte täcks av försäljningen?
Modern genteknik kan även användas på djur och mikroorganismer för att förstå sjukdomar och testa behandlingar – men också för mer direkt medicinsk användning. Det här är förstås ingen nyhet. Genmodifierade mikroorganismer har använts för att producera mänskligt insulin sedan ungefär 40 år tillbaka. Men den nya, exakta gentekniken möjliggör helt nya användningsområden. Exempelvis skulle det gå att lösa den livshotande bristen på donerade organ för transplantationer genom att odla fram anpassade celler och organ hos djur. Det är inte möjligt i dag, eftersom vävnad från djur riskerar att stötas bort och för att vävnaden kan innehålla latenta så kallade retrovirus, som orsakar nya sjukdomar hos patienten. Bägge dessa problem skulle kunna minskas med genteknik.
2017 föddes grisen Laika, det första djur som fått alla sina retrovirus inaktiverade med hjälp av genteknik. På motsvarande sätt skulle djurets proteiner kunna förändras, så att vårt immunsystem inte reagerar lika starkt på dem. En annan lösning är att sätta in mänskliga stamceller i ett djur, där cellerna utvecklas till människolika organ. Den metoden är ännu inte så långt utvecklad. Försök visar i och för sig att mänskliga stamceller klarar av att växa i djurembryon, men det är fortfarande långt kvar tills de kan utvecklas till fungerande organ.
Om några år kommer vi antagligen att se hur CRISPR-Cas9 används för att behandla en mängd olika sjukdomar, och för att skapa nya organ. Det är främst en fråga om att utveckla metoderna. Men det handlar då om genetiska förändringar som inte kan gå i arv, eftersom inga könsceller påverkas. En betydligt svårare fråga är om vi ska tillåta ärftlig genförändring, och när den tekniken i så fall ska användas. Då handlar det om själva grunden för vad som gör oss till dem vi är. Med sådana ingrepp skulle vi kunna förhindra eller minska risken för sjukdomar – men det är svårt att balansera för- och nackdelar av en genförändring hos en människa som ännu inte fötts. Ett annat dilemma är att vissa genetiska varianter kan medföra både fördelar och nackdelar. Ett sådant exempel är sicklecell-anemi, en svår ärftlig sjukdom som samtidigt ger bäraren ett ökat skydd mot malaria. Är det rätt att förhindra en viss sjukdom om det innebär en ökad risk att drabbas av en annan sjukdom? Ett annat problem är möjligheten för en patient att påverka sin behandling. En ärftlig förändring kommer att påverka kommande generationer utan att de har något att säga till om.

Kunskap baserad på vetenskap
Prenumerera på Forskning & Framsteg!
Inlogg på fof.se • Tidning • Arkiv med tidigare nummer
Förutom att förhindra sjukdom skulle ärftlig genförändring kunna användas för att förbättra egenskaper som inte är kopplade till sjukdom, eller som befinner sig i en gråzon. Vad som betraktas som sjukdom kan också förändras över tid. Är avvikande funktion en sjukdom som vi borde förebygga, eller kommer det att utarma vår tolerans för det annorlunda? Homosexualitet ansågs förr vara en sjukdom i Sverige. I dag vet vi att det är en normal variation på sexuell läggning. Även komplexa sociala och fysiska egenskaper skulle kunna gå att påverka, men vår kunskap om deras genetiska grund är fortfarande mycket liten.
Själv tycker jag att det vore mycket skrämmande om vi skulle börja skriva in vår samtids värderingar om vad som är önskvärda egenskaper i våra gener. Det skulle i förlängningen kunna förändra mänskligheten och våra samhällen i grunden, på sätt som vi sannolikt inte har förmåga att överblicka. I dag finns det mycket få förespråkare för sådan genetisk förbättring inom forskarvärlden, men den inställningen kan förändras i framtiden.
Den första beskrivna genmodifieringen av ett mänskligt embryo genomfördes i Kina och publicerades våren 2015. Avsikten var att förändra en gen kopplad till en blodbristsjukdom. Försöket gjordes på embryon som blivit över efter en provrörsbefruktning, och som hade donerats till forskning eftersom de inte kunde användas för en graviditet. De förstördes direkt efter försöket och utvecklades alltså aldrig till foster. Endast ett fåtal embryon fick den avsedda genförändringen och många embryon fick fel genförändring. Detta mycket uppmärksammade experiment ledde till att ett stort internationellt möte hölls i Washington D.C. i USA senare samma år. Där enades deltagarna om att avråda från att använda genetiskt förändrade embryon för graviditet, även i länder som inte förbjuder det – men inte att avråda från fortsatt forskning. Sedan dess har teknikens effektivitet och precision snabbt ökat till en nivå nära den som behövs för en verklig behandling. Särskilt betydelsefull var en studie i USA som publicerades 2017. Då injicerades Cas9 och en spermie samtidigt i en äggcell. De allra flesta embryon fick den önskade genetiska förändringen och inga oönskade förändringar upptäcktes. Dessutom var alla celler i respektive embryo förändrade. I tidigare försök har det ibland bildats embryon med en blandning av celler med oförändrade och förändrade gener.
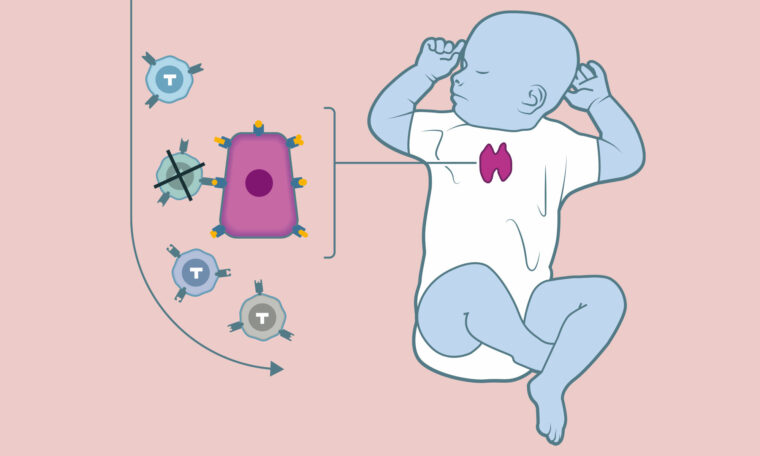
Hur skulle då genredigering kunna användas på mänskliga embryon? Redan i dag finns det en etablerad metod för att undvika att personer som är bärare av sjukdomsanlag får barn med sjukdom. Metoden kallas PGD (preimplantatorisk genetisk diagnostik) och är av stort värde för många människor. Jag har vänner som förlorat ett barn i en ärftlig sjukdom, men efter att ha genomgått behandlingen är de nu föräldrar till en underbar och frisk liten flicka. Effektiv genredigering skulle kunna användas som ett alternativ till PGD, eller för att föra in anlag som föräldrarna saknar för att minska risken för sjukdom. Som exempel har ett anlag som skyddar mot hiv-infektion förts in i mänskliga embryon i studiesyfte. Vår kunskap om vilka anlag som skyddar mot sjukdomar är i dag begränsad, men fler exempel kommer att upptäckas. Genredigering av embryon kan också utföras för att förstå embryoutvecklingen bättre, vilket skulle kunna leda till nya behandlingar av exempelvis ofrivillig barnlöshet.
Vad kom vi då fram till under mötet i Stockholm? Diskussionen gjorde klart att det behövs en omfattande debatt och översyn av lagar och regler – för att kunna ta ställning till bland annat de frågor som jag tagit upp i den här texten. Några månader efter mötet skrev Statens medicinsk-etiska råd en uppmaning till en parlamentarisk utredning, för att ta fram nya strategier och lagstiftning för hur genteknik ska användas på människa. Min förhoppning är att en eventuell framtida användning ska vara begränsad till sjukdomar som orsakar stort lidande. Det är viktigt att vi tar till vara på genteknikens möjligheter. Men vi måste samtidigt vara ytterst uppmärksamma på de omfattande etiska frågeställningar som väcks kring hur vi ska se på människor och våra egenskaper i dag och i framtiden.
Magnus Lundgren
Magnus Lundgren är forskare vid Institutionen för organismbiologi, Uppsala universitet. Han har tidigare lett en forskargrupp som studerar hur CRISPR-Cas-systemet fungerar och kan användas.