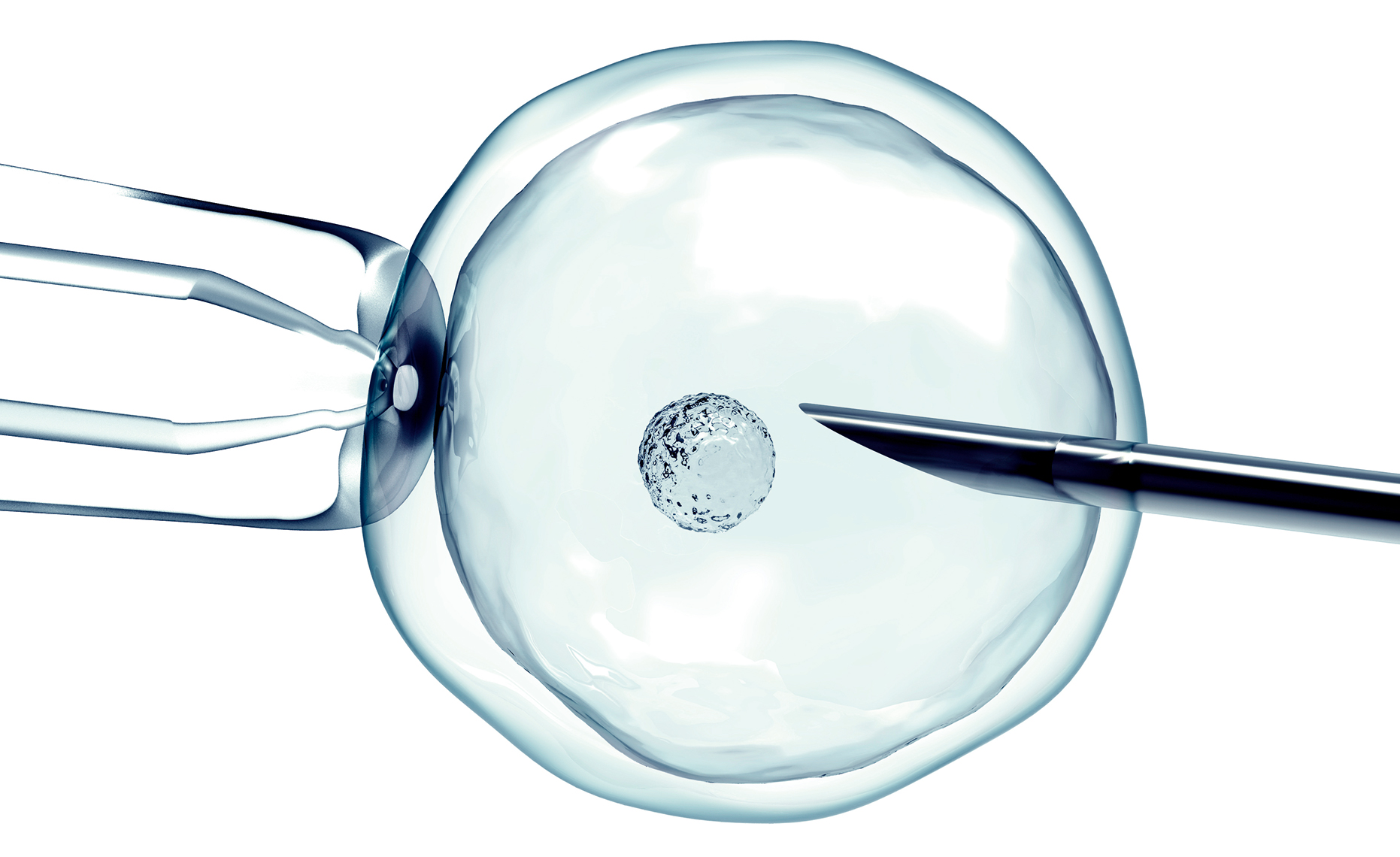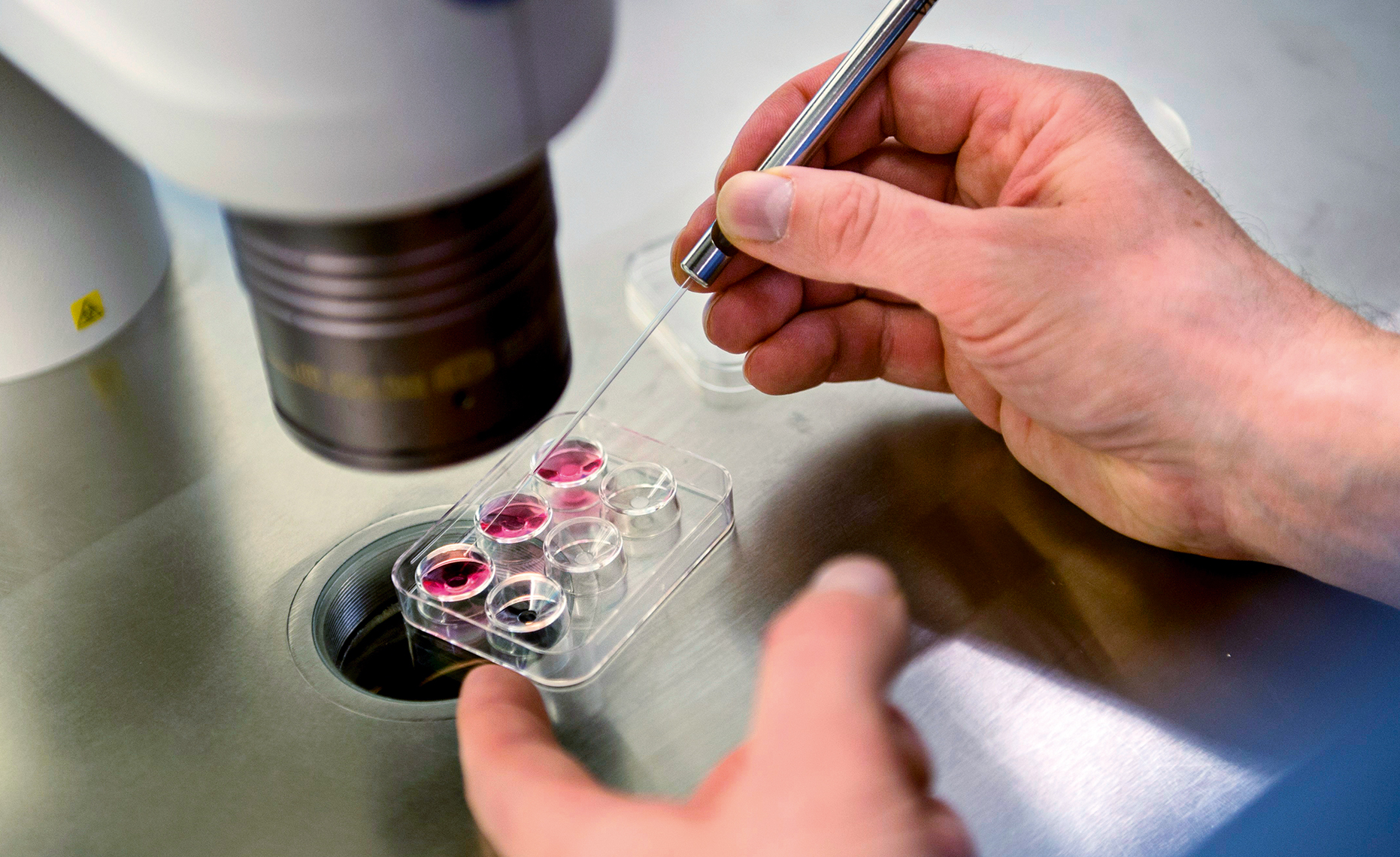
Det första provrörsbarnet föddes för över 40 år sedan. Nu är nya behandlingsmetoder på gång för att hjälpa människor med barnlängtan att bli föräldrar.
Bild: Getty images
Forskarnas jakt på nya sätt att bli med barn
Att inte kunna bli förälder är ofta en stor sorg för människor med barnlängtan. Provrörsbefruktning hjälper många att bilda familj, men inte alla. Därför är nya tekniker under utveckling – som kanske kan innebära slutet för ofrivillig barnlöshet.
Strax innan hon fyllde 40 år träffade Emelie Ljungberg mannen i sitt liv. De kände efter ett par år att de ville ha barn. Efter ett tidigt missfall testade paret provrörsbefruktning, IVF (in vitro-fertilisering). Men de försök som ledde till att Emelie blev gravid slutade också med missfall.
Andra i samma situation hade kanske gett upp och ställt in sig på ett liv utan barn. Men paret Ljungbergs barnlängtan var stor, och de ville inte ge upp. Att ställa sig i adoptionskö i 40-årsåldern var inget alternativ, då köerna var långa och många länder har åldersgränser för blivande föräldrar.
Snart hade de även nått åldersstrecket för att få hjälp med IVF i Sverige. De valde då att vända blicken mot utländska kliniker. Där fanns också hjälp som kunde anpassas mer efter Emelies förutsättningar. Hon har astma och den autoimmuna sjukdomen hypotyreos (brist på sköldkörtelhormon). Det innebär att hennes immunförsvar är starkt och att hon nästan aldrig är sjuk. Det kan låta som en fördel, men i Emelies fall skulle det visa sig vara ett problem.
– Redan hemma i Göteborg hade jag fått hjälp av en läkare att skriva ut en låg dos kortison – för att dämpa mitt alldeles för starka immunförsvar som troligen stötte bort embryot, säger hon.
Fertilitetsvård är inte enkel och det kan vara svårt att hitta rätt i det stora utbudet av behandlingar. Bäst statistik över lyckade behandlingar (som leder till att friska barn föds) har de kliniker som individanpassar vården. Det finns alltså inte ett sätt som passar alla, något som snart stod klart för Emelie Ljungberg.
Fertilitetsklinik specialiserad på immunförsvar
På ett internet-forum hittade paret info om en fertilitetsklinik i Aten som specialiserat sig på immunförsvaret.
– Det fanns liknande kliniker i USA och Storbritannien, men vi valde den grekiska kliniken, säger Emelie Ljungberg, som också skrivit en bok om sin resa mot att få barn – Längtansresan.
Inför det nya IVF-försöket fick hon bland annat medicin med TNF-alfa-hämmare, inflammationsdämpande proteiner. När inte heller det fungerade rekommenderade läkaren paret att gå över till äggdonation. Då används ägg från en annan kvinna vid IVF-behandlingen.
Emelie Ljungberg och hennes man är långt ifrån ensamma om att söka vård för ofrivillig barnlöshet. I Sverige söker cirka 15 procent av paren i fertil ålder hjälp för att få barn, och det blir fler för varje år. Cirka 50 000 svenska barn har hittills kommit till genom IVF.
Det första så kallade provrörsbarnet, där befruktningen sker i ett provrör och embryot därefter sätts in i kvinnans livmoder, föddes för över 40 år sedan. Brittiska Louise Brown lever i dag ett helt vanligt liv med man och barn i Bristol. Fysiologen och genetikern som ordnade så att hon blev till – Robert Edwards vid universitetet i Cambridge – fick Nobelpriset för sitt arbete 2010.
I dag är IVF en etablerad behandling för ofrivilligt barnlösa i många länder. Miljögifter och samhällsutvecklingen, där fler väljer att bilda familj senare i livet, har lett till ökat behov av fertilitetsbehandling.
Preimplantatorisk genetisk testning
För många som längtar efter barn räcker det dock inte med vanlig IVF. Därför fortsätter utvecklingen av nya behandlingsmetoder. En metod som finns hos allt fler kliniker är så kallad PGT, preimplantatorisk genetisk testning (benämns ibland även PGS eller PGD). Det innebär att embryots gener undersöks innan de sätts in i livmodern – en sorts genetisk fosterdiagnostik.
Syftet är att upptäcka om embryot bär på sjukdomsgener eller förändringar som kan leda till att IVF-behandlingen misslyckas eller slutar med missfall. Embryon med allvarliga kromosomfel sorteras bort. I Sverige får PGT endast användas om mannen eller kvinnan bär på anlag för en allvarlig ärftlig sjukdom, exempelvis Huntingtons eller Steinerts sjukdom, som kan överföras till barnet. Hos en del utländska klinker räcker det att kvinnan drabbats av upprepade missfall, för att få göra PGT.
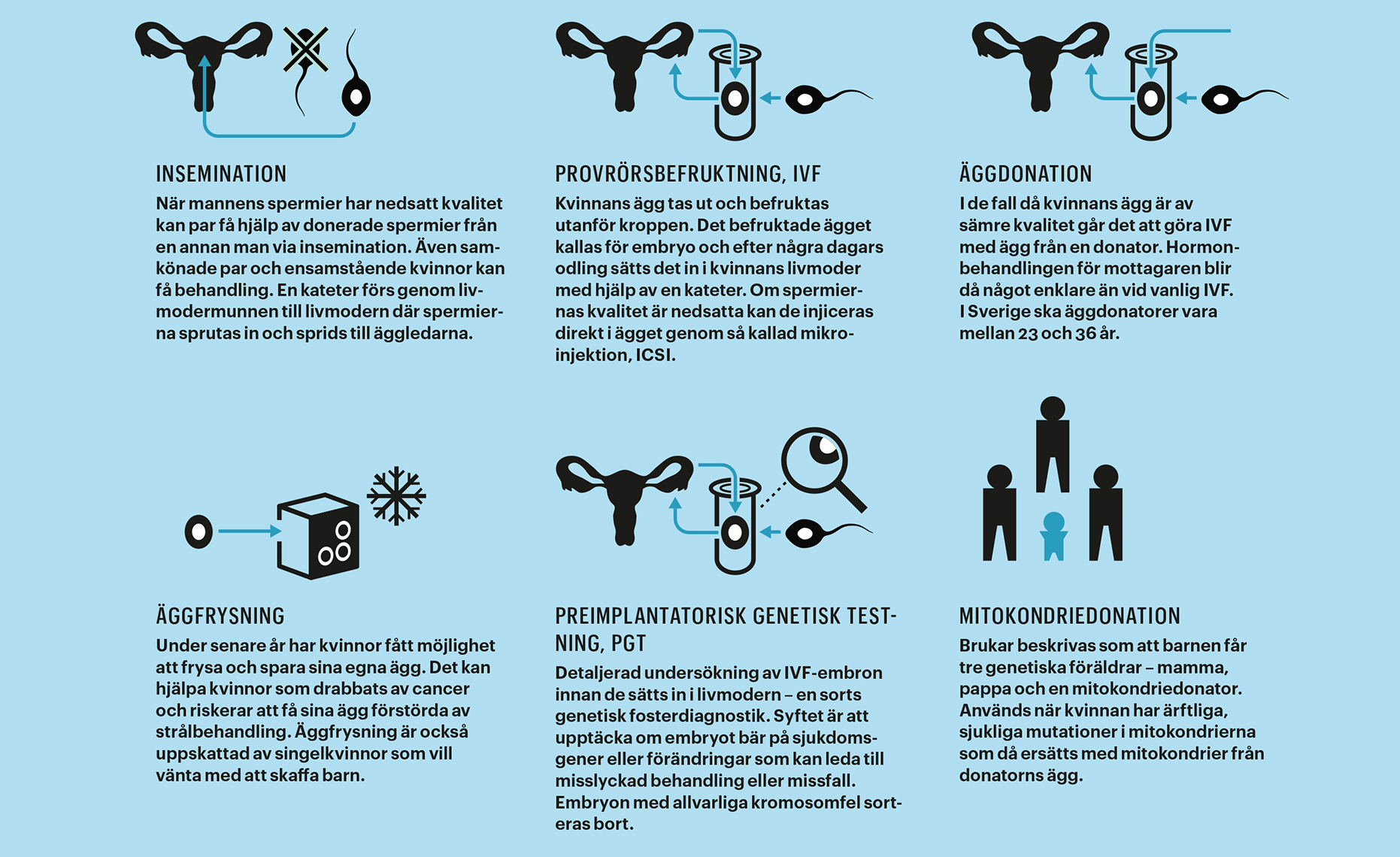
Hjälp mot barnlöshet – nu och i framtiden
Genetisk diagnostik används än så länge vid ganska få fertilitetsbehandlingar, och främst för att sortera bort skadade embryon. Men nya dörrar till att genmanipulera ofödda barn har öppnats på senare tid, bland annat genom den så kallade gensaxen (crispr/cas9).
Gensaxen, som belönades med Nobelpris 2020, är hyllad och välkomnad av många forskare. Verktyget gör det möjligt att mycket precist redigera i generna. Men som med all teknik finns också risk för missbruk. En händelse i Kina 2018 skakade om forskarvärlden och har lett till flera utredningar och rapporter. Den kinesiske forskaren He Jiankui meddelade då att han hjälpt ett par, där pappan hade hiv, att få barn som var resistenta mot sjukdomen. Men att förändra dna i mänskliga embryon som sedan inplanteras är olagligt i de flesta länder, och forskaren sitter nu i fängelse.
– Ett av problemen var att ingen etisk genomlysning gjordes före behandlingen. I det här fallet var genredigering inte heller medicinskt nödvändig och därför inte till barnens bästa, säger Fredrik Lanner, forskare i obstetrik och gynekologi vid Karolinska institutet.
Han är annars positiv till den nya tekniken som gör det möjligt att reparera gener som medför allvarlig sjukdom. Om användningen av gensaxen regleras på bra sätt kan den bli ett fantastiskt redskap.
– Men tekniken har långt kvar innan vi kan använda den kliniskt, för patienter. Exempelvis finns risk för att gensaxen råkar klippa fel, vilket kan ge oförutsägbara förändringar i dna, säger Fredrik Lanner.
En vågdelare för hur och var genredigeringen kan komma att användas är om förändringarna går i arv. Det menar Anna Wedell, professor i medicinsk genetik vid Karolinska institutet. De senaste två åren har hon varit svensk representant i den internationella kommissionen för klinisk användning av genredigering i mänskliga könsceller. Kommissionen drevs av vetenskapsakademier världen över.
En rapport om arbetet publicerades i höstas och under våren kommer Världshälsoorganisationen, WHO, med en uppföljning.
– Det är stor skillnad om tekniken används för att ändra gener i kroppsceller, för att behandla sjukdomar. Då blir förändringarna inte ärftliga, säger Anna Wedell, vars forskning huvudsakligen handlar om medfödda sjukdomar i ämnesomsättningen och problem orsakade av cellernas mitokondrier.
Första mitokondriedonationen
I april 2016 spreds nyheten över världen att ett barn fötts med tre föräldrar. Det var världens första mitokondriedonation. Barnen får då tre genetiska föräldrar – mamma, pappa och en mitokondriedonator.
I stora drag går det till så att mitokondrier med skadat dna i mammans ägg byts ut mot mitokondrier från donatorn. På så vis får kvinnor med ärftliga, sjukliga mutationer i mitokondrierna möjlighet till friska barn.
– Det här är jättespännande, eftersom mitokondriesjukdomarna är allvarliga och kan leda till att barn dör snart efter förlossningen, säger Fredrik Lanner.
Två kvinnor har hittills behandlats med metoden, vid en klinik i brittiska Newcastle. De bar på mutationer som orsakar Merrfs syndrom, en sorts epilepsi som även kan medföra tidig dövhet eller demens hos barnen.
Eftersom förändringarna som skapas vid mitokondriedonation går i arv till kommande generationer är metoden kontroversiell i många länder. Storbritannien legaliserade mitokondriedonation 2015. I Sverige är den än så länge inte laglig, och Anna Wedell ser inget stort behov av att snabbt ändra svensk lag. Det här rör trots allt ett litet antal drabbade familjer, som skulle kunna få hjälp i Storbritannien. Erfarenheterna därifrån behöver också utvärderas mer innan metoden sprids, menar hon.
Ett annat alternativ för många patienter är äggdonation, eftersom mitokondrier endast överförs från kvinnans ägg. Generna kommer då i sin helhet från donatorn.
Möjligheten att få hjälp med donation av ägg och/eller spermier finns hos många utländska klinker och även i Sverige. Men donationer har begränsningar. Många människor kan inte tänka sig att använda könsceller från en annan person, utan vill ha sina egna. I Sverige råder dessutom ofta brist på donatorer, vilket driver patienter till dyra behandlingar utomlands.
En viktig skillnad mellan donationer i Sverige och i andra länder är att i Sverige kan barnet i vuxen ålder få reda på vem donatorn är. Utomlands är donatorer ofta anonyma. Detta var något som paret Ljungberg behövde ta ställning till inför äggdonationsbehandlingen i Aten där donatorerna är anonyma.
– Det var nog det svåraste beslutet för oss, men vi valde ändå att gå vidare med den grekiska kliniken som erbjöd bra hjälp, säger Emelie Ljungberg.
Konstgjorda ägg och spermier
Ny forskning kan komma att förändra läget fundamentalt. I framtiden kanske inte ens donerade eller egna könsceller behövs för att skapa nytt liv. Redan 2006 visade den japanska forskaren Shinya Yamanaka att det går att bygga om exempelvis hudceller, från möss och människor, till så kallade pluripotenta stamceller. Dessa kan i sin tur utvecklas till konstgjorda ägg eller spermier.
Gensaxen belönades med Nobelpris i kemi
Bild: Getty images
Upptäckten av den så kallade gensaxen (crispr/cas9) ledde till Nobelpris i kemi 2020 för forskarna Emmanuelle Charpentier och Jennifer A. Doudna. Verktyget gör det möjligt att redigera inuti gener (dna) och kan användas inom en rad områden, exempelvis veterinärmedicin och jordbruk. Mest uppmärksammat är att gensaxen kan bidra till utvecklingen av nya behandlingar för allvarliga sjukdomar hos människor.
Metoden innehåller två delar – dels en instruktion (med rna) för var klippet ska ske, dels själva saxen som består av enzymet cas9 som klipper sönder den aktuella genen. En korrigerande gen kan sedan föras in i stället, vilket botar sjukdomen.
Metoden kallas för IVG (in vitro gametogenesis) och öppnar nya portar för ofrivilligt barnlösa. Patienter som helt saknar könsceller skulle kunna få genetiskt egna barn. Samkönade par skulle kunna få barn med gener från båda parter.
IVG diskuteras ännu så länge mest bland stamcellsforskare. De inducerade pluripotenta stamcellerna (iPSC) kan nämligen även underlätta för forskningen. Överblivna embryon från IVF-behandlingar, som i dag används för forskning kring svåra sjukdomar, skulle kunna ersättas av embryon som odlats fram på det nya sättet. Det blir inte längre någon brist på embryon för forskningen.
Utvecklingen av IVG har gått vidare på senare år. 2016 publicerade de japanska forskarna Mitinori Saitou och Katsuhiko Hayashi en artikel i tidskriften Nature där de beskrev hur de skapat ägg av celler från en mussvans. De framodlade äggen användes sedan vid befruktningen av en mushona som födde åtta friska ungar. Mitinori Saitou och flera andra forskare har nu gått vidare med att studera människoceller.
Hur lång tid det tar innan IVG når fertilitetsklinikerna vet ingen i dag. Men forskaren Katsuhiko Hayashi tror att produktionen av konstgjorda mänskliga ägg kan vara igång om fem år. Därefter kan det ta 10 till 20 år innan metoden når fertilitetsklinikerna.
Noggrann etisk analys
Innan nya metoder tas i bruk behöver samhället göra en noggrann etisk analys. Det menar Nils-Eric Sahlin, professor i medicinsk etik vid Lunds universitet.
Ofrivillig barnlöshet en sjukdom
Ofrivillig barnlöshet klassas som sjukdom av Världshälsoorganisationen, WHO, och lidandet bedöms som stort för de som drabbas. Sverige skrev under WHO:s definition 1997. Inom vården bör patienter få behandling mot sjukdomen, så länge det finns möjligheter till lyckat resultat. Men sjukdomen räknas till gruppen mindre svåra akuta och kroniska sjukdomar.
Behandlingar i Sverige utförs också i enlighet med lagen om genetisk integritet. För några år sedan gjordes uppdateringar av svensk lagstiftning på det här området. 2016 fick ensamstående kvinnor samma rätt till fertilitetshjälp som par. 2019 blev donation av både ägg och spermier, så kallad dubbeldonation, tillåten. Men möjligheterna till behandling är fortfarande begränsade, eftersom köerna är långa i många regioner.
– En viktig fråga är om man alltid ska använda de mest avancerade metoderna. Det finns en stark önskan att gå i teknikutvecklingens riktning. Men det är inte riskfritt att göra om hudceller till könsceller. Det kan få effekter som visar sig först i nästa generation eller senare, säger Nils-Eric Sahlin, som också är sakkunnig i Statens medicinsk-etiska råd, Smer.
Även Fredrik Lanner menar att det är långt kvar innan IVG kan bli en behandling för patienter. Många studier behövs, helst över flera generationer, av bland annat epigenetiska förändringar, alltså ändringar i regleringen av gener (när de slås på och av), som uppstår av yttre påverkan och kan bli ärftliga.
– Men för oss forskare är det här mycket intressant redan nu, exempelvis för att studera processen då mogna spermier och ägg blir till. Genom det kan vi förstå mer om varför en del har dåliga ägg och spermier. Det kommer att leda till att fler får rätt behandling, säger Fredrik Lanner.
Riskerna med de nya teknikerna diskuteras på olika håll i världen, bland annat inom EU-projektet Sienna som avslutas under våren 2021. Där utreds IVG, genredigering och urval av embryon. Varnande röster har höjts för att de nya metoderna skulle kunna användas för att skapa så kallade ”designer babies”, det vill säga ofödda barn som genmanipulerats för att få vissa, önskade egenskaper som kön eller intelligensnivå. Om sjukdomsgener kan klippas bort med gensaxen kan förstås även andra egenskaper ändras.
Inom ramen för Sienna-projektet har enkäter gjorts med människor i elva länder, för att få veta mer om folks uppfattning om de nya möjligheterna. En förhoppning är att resultaten kommer att användas i arbetet med ny lagstiftning.
Familjens dröm uppfylldes
För de som går runt med barnlängtan just nu är de här diskussionerna till föga hjälp. Då är det befintlig vård som gäller. För Emelie Ljungberg var det, utöver medicineringen av immunförsvaret också äggdonation och en behandling av livmodern med hennes egen blodplasma som till slut gav resultat.
Metoden kallas PRP (platelet rich plasma) och är i Sverige vanligast inom kosmetisk vård, exempelvis mot håravfall. I Emelies fall hjälpte det livmoderslemhinnan att växa sig tillräckligt tjock, så att embryot kunde fästa och växa.
Familjens dröm gick i uppfyllelse. Paret har fått tvillingar, en tjej och en kille, som snart är ett år gamla.
– Vi mår jättebra allihop, säger Emelie Ljungberg.

Bild: Ulf Sirborn
Marie Granmar är journalist och författare som 2013 utkom med boken Operation barn – om kampen för att bli förälder.

Prenumerera på Forskning & Framsteg!
10 tidningsnummer om året och dagliga nyheter på fof.se med kunskap baserad på vetenskap.